Тема: Катализ в химической технологии
План:
1. Основные положения сложного катализа в химико-технологических процессах нефтехимического синтеза
2. Теория промежуточных соединений в катализе и их термодинамические и кинетические аспекты
3. Автокатализ
5. Гомогенный катализ
6. Гетерогенный катализ
Основные положения сложного катализа в химико-технологических процессах нефтехимического синтеза
Катализом называется изменение скорости химических реакций под действием особых ускорителей – катализаторов.
Катализ – явление физико-химическое, темно связанное со скоростью и с механизмом химических реакций. Практическое значение катализа очень велико. Его применение давно стало необходимостью в нефтехимической и химической промышленности, в производстве синтетических каучуков и смол, смазочных веществ, растворителей, лекарственных препаратов и
т. д.
Основные положения науки о катализе:
Ø катализатором является вещество, которое ускоряет определенную реакцию, непосредственно участвуя в ней, но после окончания реакции выделяется вновь в неизменном виде;
Ø катализатор лишь ускоряет реакцию, но не смещает термодинамического равновесия в сторону образования целевого продукта.
Количество катализатора, необходимое для изменения скорости реакции, всегда очень невелико. Действие катализатора специфично, он изменяет скорость только одной какой-то реакции или группы однотипных реакций.
Таким образом, ускоряя одну из возможных реакций, катализатор способствует увеличению селективности (избирательности) по целевому продукту.
В ряде процессов применение катализаторов разного действия позволит получить со значительным выходом различные продукты. Например, окисление этилена на серебряном катализаторе лежит в основе производства оксида этилена, а на палладиевом катализаторе значителен выход ацетальдегида.
Основные группы каталитических процессов:
Ø гомогенные;
Ø гетерогенные;
Ø ферментативные.
При гомогенном катализе и катализатор, и реагенты находятся в одной фазе (газовой или жидкой). При гетерогенном катализе катализатор и реагенты или продукты реакции находятся в разных фазах (обычно применяют твердые катализаторы). При ферментативном катализе катализатор находится в коллоидном состоянии.
Ферментативные каталитические процессы протекают в биологических системах под воздействием ферментов.
Теория промежуточных соединений в катализе и их термодинамические и кинетические аспекты
Сущность катализа заключается в образовании промежуточных активированных комплексов субстрата с катализатором. Это вызывает перераспределение электронной плотности в молекуле субстрата и делает ее реакционноспособной.
Любой каталитический процесс является равновесным процессом. Образование промежуточного активированного комплекса, а затем перегруппировка связей в нем требует затраты энергии активации. Распад промежуточного комплекса связан с увеличением энтропии, т.е. термодинамически возможен и самопроизволен. Использование катализатора способствует либо распаду (разрыхлению) промежуточного комплекса, либо его образованию. И то, и другое приводит к увеличению скорости реакции. В гетерогенном катализе образование активированного промежуточного комплекса связано с сорбцией исходных веществ на поверхности катализатора, т.е. с адсорбцией.
Действие катализатора связано с экзотермическим эффектом ∆Н#  адсорбции активированного комплекса на катализаторе.
адсорбции активированного комплекса на катализаторе.
В случае гомогенного катализа
А + В 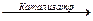 С. (5.1)
С. (5.1)
Вначале образуется промежуточное соединение – субстрат-катализатор:
k1
А + В + Kt ↔ AKt + B, (5.2)
k-1
где Kt – катализатор; k1 и k-1 – константы скорости соответственно прямой и обратной реакций.
Затем происходит образование активированного комплекса со вторым реагентом, константа скорости которого k2:
AKt + B  [ AB#] Kt. (5.3)
[ AB#] Kt. (5.3)
В дальнейшем активированный комплекс распадается с выделением катализатора и конечных продуктов реакции, константа скорости которого k3:
[ AB#] Kt  C + Kt. (5.4)
C + Kt. (5.4)
Действие гомогенного катализа в подавляющем большинстве случаев определяется экзотермическим эффектом образования активированного комплекса. В гомогенном катализе скорость реакции прямо пропорциональна концентрации катализатора.
Снижение энергии активации в каталитической реакции может быть связано и с тем, что промежуточные соединения состоят из меньшего числа молекул, чем это необходимо для некаталитической реакции.
Скорость реакции тем больше, чем меньше энергия активации Е, и вследствие экспоненциальной зависимости
k = k0 e-(E/RT) (5.5)
Влияние катализатора на снижение энергии активации можно проиллюстрировать следующими данными: энергия активации некаталитических реакций 125-190 кДж/моль, энергия активации реакций гомогенного и гетерогенного катализа 70-120 кДж/моль, энергия активации реакций ферментативного катализа 35-70 кДж/ моль.
Автокатализ
Автокаталитическими называются реакции, в которых катализатором является один из промежуточных или конечных продуктов реакции. Так, в цепных реакциях автокатализаторами служат свободные радикалы. К числу автокаталитических относятся некоторые реакции разложения взрывчатых веществ, горения, полимеризации и другие.
Для автокатализа характерна малая скорость реакций в начальный период, называемый периодом индукции, и быстрое нарастание выхода продукта в последующий период в результате возрастания количества катализатора. В дальнейшем выход продукта увеличивается согласно закону действующих масс, так же как и для обычных реакций.
Для возбуждения цепных реакций в исходную смесь обычно вносится вещество (инициатор), которое, реагируя с исходным веществом, вызывает зарождение цепи, т.е. образование первых свободных радикалов, и таким образом ускоряет реакцию подобно катализатору. Однако инициаторы в
отличие от типичных катализаторов расходуются в процессе реакции.
Гомогенный катализ
Гомогенный катализ может протекать в газовой или жидкой фазе. Механизм гомогенного катализа состоит в образовании между реагентами и катализаторами нестойких, промежуточных соединений, существующих в той же фазе (газовой или жидкой), после распада которых образуется продукт реакции, а катализатор регенерируется. В отличие от гетерогенно-каталитических реакций при гомогенных реакциях состав промежуточных соединений в ряде случаев можно выявить анализом. Процессы гомогенного катализа классифицируются:
Ø по типу взаимодействия между реагирующими веществами и катализатором на окислительно-восстановительные и кислотно- основные;
Ø по фазовому состоянию на жидкофазные (в растворах) и газофазные.
При выборе катализатора особое значение имеют его активность и селективность, доступность, относительно низкая стоимость, малая коррозионная способность, малое воздействие на окружающую среду.
Гомогенные катализаторы очень активны, но имеют определенные недостатки:
Ø сложность отделения катализатора от реакционной массы (отмывка, отгонка), при котором может образовываться большое количество токсичных или загрязненных сточных вод;
Ø сложность регенерации, что увеличивает долю катализатора в себестоимости продукции;
Ø коррозионность.
Катализаторами в растворах служат кислоты (катион Н+), основания (анион ОН - ), ионы металлов (Ме+, Ме2+), а также вещества, способствующие образованию свободных радикалов.
Механизм кислотно-основного (ионного) катализа в растворах заключается в том, что идет обмен протонами между катализатором и реагирующими веществами, сопровождающийся внутримолекулярными превращениями. При кислотном катализе протон (или положительный ион) переходит сначала от катализатора к реагирующей молекуле, а при основном катализе катализатор служит вначале акцептором протона или донором аниона по отношению к молекуле реагента. В последующей стадии каталитической реакции протон перемещается в обратном направлении, и катализатор восстанавливает свой состав.
По такому типу протекают реакции гидратации, дегидратации, гидролиза, этерификации, поликонденсации в растворах. Примером кислотно-основного катализа в растворе может служить гидратация олефинов в спирты, катализируемая кислотами (НА).
В общем виде
RCH=CH2 + HA 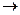 RCH2−CH
RCH2−CH 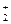 + A- (a)
+ A- (a)
RCH2−CH 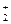 + HOH
+ HOH 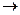 RCH2−CH2OH + H+ (б)
RCH2−CH2OH + H+ (б)
Н+ + А- 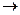 НА (в)
НА (в)
На стадии (а) катализатор служит донором протона; на стадии (в) катализатор регенерируется.
К ионным относятся и окислительно-восстановительные каталитические реакции в растворах, ускоряемые ионами металлов с переменной степенью окисления (меди, марганца, железа).
Газофазный гомогенный катализ (процесс, при котором и реагенты, и катализатор – газы) применяют сравнительно редко. Примером его могут служить дегидратация уксусной кислоты в парах при участии катализатора (парообразного тиэтилфосфата); окисление метана в формальдегид кислородом воздуха, ускоряемое оксидами азота.
Газофазний катализ может осуществляться по молекулярному и радикальному цепному механизму.
Ø При молекулярном механизме каталитической реакции происходит обмен атомами между катализатором и реагирующими веществами.
Ø Радикальный механизм гомогенного катализа возможен как в газовой, так и в жидкой фазе. Катализатор служит инициатором, направляющим реакцию по цепному механизму. Ускорение достигается в результате появления богатых энергией частиц – свободных радикалов в процессе самой реакции. По такому механизму протекают некоторые окислительные реакции в газах, полимеризация в жидкой фазе и т. п.
Скорость гомогенного каталитического процесса возрастает с повышением концентрации исходных веществ и катализатора согласно закону действующих масс.
Повышение давления ускоряет газовые реакции, так как с ростом давления увеличивается концентрация реагентов. Повышение температуры вызывает ускорение гомогенных реакций в соответствии с уравнением Аррениуса. Перемешивание имеет наибольшее значение для жидкостных процессов, так как скорости диффузии в жидкостях в десятки и сотни тысяч раз меньше, чем в газах. Перемешивание растворов позволяет сильно увеличить общую скорость процесса за счет снятия диффузионных торможений.
Основным недостатком гомогенного катализа является трудность выделения катализатора из конечной продукционной смеси (жидкости или газа), в результате чего часть катализатора теряется безвозвратно, а продукт загрязняется им.
Гетерогенный катализ
Гетерогенный катализ имеет большое значение в промышленности. С его помощью осуществляются дегидрирование (изопрена, дивинила, стирола), гидрирование (циклогексана, аминов), окисление (оксида этилена, окислительный аммонолиз с получением акрилонитрила), а также гидратация, алкилирование и другие.
Гетерогенный катализ имеет ряд преимуществ перед гомогенным катализом:
Ø малый расход катализатора на единицу количества продукта;
Ø снижение количества или устранение сточных вод;
Ø отсутствие расходов на выделение катализатора из раствора (он легко отделяется от реакционной массы или не захватывается ею);
Ø снижение капитальных затрат;
Ø снижение опасности коррозии;
Ø увеличение продолжительности использования (одна загрузка катализатора может работать длительное время – до нескольких месяцев, года).
Катализатор представляет собой носитель (основу), на который различными методами нанесена активная часть.
По способу осуществления гетерогенно-каталитические процессы можно разделить на три разновидности:
Ø со стационарным неподвижным катализатором (зерна катализатора диаметром 3-10мм);
Ø с подвижным шариковым катализатором, перемещаемым по зонам реактора механическим транспортером;
Ø с плавающим (псевдоожиженным) пылевидным (диаметр зерен 1-2мм) катализатором, диспергированным в потоке реагентов, способным перемещаться по зонам реактора пневматически.
Катализатор должен отвечать ряду требований:
Ø высокая каталитическая активность;
Ø достаточно большая селективность по целевому продукту;
Ø простота получения, обеспечивающая воспроизводимость каталитических свойств;
Ø достаточная стабильность свойств и способность к регенерации, т.е. к восстановлению активности;
Ø высокая механическая прочность при сжатии, ударе, истирании;
Ø небольшие экономические затраты на единицу продукции.
Промышленные катализаторы – это смеси, называемые контактным и массами. В состав контактных масс входят вещества – собственно катализаторы, носители и промоторы.
Катализаторы – это оксиды металлов (железа, алюминия, кобальта и др.); железо, медь и другие металлы, некоторые соли; хлорная ртуть, алюмосиликаты и другие вещества.
Носителями, или трегерами, называют термостойкие, прочные, пористые вещества, на которые осаждением из раствора или другим способом наносят катализатор. Носители (пемза, асбест, каолин, уголь и другие высокопористые вещества) увеличивают пористость катализатора, делают его прочным и снижают его стоимость.
Промоторы повышают активность катализатора. К ним относятся, например, оксиды калия, кальция, алюминия и некоторые другие вещества.
Эффективность использования катализаторов в промышленных гетерогенно-каталитических процессах существенно зависит от их технологических характеристик: активности, температуры зажигания, селективности действия, устойчивости к ядам, пористости, механической прочности, теплопроводности, доступности и дешевизны.
Активностью катализатора А называется степень его ускоряющего воздействия на данную химическую реакцию. Она определяется как
соотношение констант скоростей каталитической kкат и некаталитической k реакций:
k кат k0 кат exp (-  )
)
А = ─── = ────────────, (6.1)
k k0 exp (-  )
)
где k0 кат и k0 - предэкспоненциальные коэффициенты; Е – энергия активации реакции в отсутствие катализатора; Екат – энергия активации реакции с катализатором.
Для тех случаев, когда каталитическая и некаталитическая реакции имеют один порядок и, следовательно, предэкспоненциальные коэффициенты в уравнении Аррениуса для них одинаковы (k0 кат = k0 ), активность катализатора
А= exp ( ), (6.2)
), (6.2)
где ∆Е = Е − Екат.
Снижая энергию активации реакции, катализатор ускоряет ее на много порядков.
Температурой зажигания катализатора Тзаж называется минимальная температура, при которой процесс начинает протекать с достаточной для технологических целей скоростью. Чем выше активность катализатора, тем ниже температура его зажигания. При низкой температуре зажигания расширяется рабочий интервал между нею и режимной температурой процесса, упрощается конструкция реактора, уменьшается расход тепла на подогрев реагентов, стабилизируется технологический режим. Для экзотермических каталитических реакций при некоторой температуре зажигания скорость выделения тепла становится равной скорости ее отвода (расход тепла на нагрев реакционной смеси и унос тепла с продуктами реакции). В этом случае температура зажигания является той минимальной температурой, при которой обеспечивается автотермичность процесса.
Селективностью катализатора называется его способность избирательно ускорять одну из реакций, если в системе термодинамически возможно протекание нескольких реакций. Для сложной реакции, состоящей из двух параллельных реакций, протекающей по схеме

 С
С
 А ─ │ (6.3)
А ─ │ (6.3)

 Р
Р
и включающей реакции А 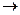 С и А
С и А 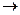 Р, которые характеризуются соответственно константами скорости k1и k2 и энергиями активации Е1 и Е2; селективность по направлению А
Р, которые характеризуются соответственно константами скорости k1и k2 и энергиями активации Е1 и Е2; селективность по направлению А 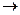 С определится как
С определится как
S 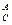 = f [
= f [  exp(
exp( )]. (6.4)
)]. (6.4)
Из этой формулы следует, что при некоторой заданной температуре Т можно путем подбора катализатора изменять разность Е2 – Е1 и, следовательно, направить процесс в строну образования целевого продукта.
Селективность катализатора имеет большое значение в таких химико-технологических процессах, как окисление аммиака в производстве азотной кислоты, различных процессах органического синтеза.
Пористость катализатора характеризует его удельную поверхность и влияет на площадь поверхности контакта катализатора с реагентами. Для каталитических процессов большое значение имеет доступность поверхности твердого катализатора для реагирующих веществ, так как чем больше поверхность контакта, тем выше скорость превращения их в целевые продукты в единицу времени.
Пористость катализатора выражается отношением свободного объема пор к общему объему катализатора и характеризуется его удельной поверхностью, т.е. поверхностью, отнесенной к единице массы или объема катализатора. Современные катализаторы имеют весьма развитую удельную поверхность, достигающую 10-100м2/г.
Механическая прочность контактной массы должна быть такой, чтобы она не разрушалась под действием собственной массы в аппаратах с неподвижным слоем катализатора и не истиралась в аппаратах с движущимся слоем катализатора и аппаратах с «кипящим» слоем катализатора.
Устойчивость к контактным ядам. Практическому использованию гетерогенно-каталитических процессов препятствует снижение активности катализатора в ходе процесса. Причинами этого являются: уменьшение активной поверхности при осаждении пыли или продуктов реакции; механическое разрушение; отравление каталитическими (контактными) ядами.
Отравлением катализатора называется частичная или полная потеря его активности под воздействием незначительного количества некоторых веществ (контактных ядов). Они образуют с активированными центрами катализатора химические соединения, прочно удерживающиеся на его поверхности, и блокируют их, снижая, таким образом, активность катализатора. Для каждой группы катализаторов существуют определенные виды контактных ядов.
Отравление катализатора может быть обратимым, когда контактные яды снижают активность катализатора временно, пока находятся в зоне катализа, и необратимым, когда активность катализатора не восстанавливается после удаления контактных ядов из зоны катализа. Контактные яды могут содержаться в реагентах, поступающих в каталитический процесс, а также образовываться в качестве побочных продуктов в самом процессе. Устойчивость к контактным ядам является важнейшим свойством промышленных катализаторов. Для удлинения срока службы контактных масс в химико-технологических процессах предусматривается стадия тщательной очистки реагентов от вредных примесей и регенерирование катализатора (например, выжигание высокоуглеродистой полимерной пленки, обволакивающей зерна катализатора, в процессах каталитического крекинга нефтепродуктов, изомеризации и дегидрирования органических соединений).