Термодинамическая система. Термодинамический процесс.
Термодинамическая система - совокупность макроскопических тел, обменивающихся энергией между собой и с окружающей средой.
Термодинамический процесс - совокупность изменений состояния термодинамической системы при переходе из одного состояния в другое.
Обратимые и необратимые процессы.
Равновесное состояние тела - такое, при котором во всех точках объема параметры состояния одинаковы.
Равновесный процесс - процесс перехода термодинамической системы из одного состояния в другое через равновесные состояния тела в любой момент времени.
Неравновесный процесс - процесс, включающий неравновесные состояния.
Обратимый процесс - процесс, который протекает в прямом и обратном направлении через одни и те же равновесные состояния.
Условия обратимости:
1. Отсутствие химических реакций.
2. Отсутствие внутреннего и внешнего трения.
3. Бесконечно медленное изменение состояния рабочего тела.
Необратимый процесс - процесс, который самопроизвольно протекает только в одном направлении.
2.Физические свойства жидкостей и газов, удельные параметры состояния. Уравнение состояния идеальных газов, его формы.
Взаимное преобразование теплоты в механическую энергию в тепловых машинах осуществляются при помощи рабочего тела.
В качестве рабочего тела обычно используют пар или газ, т.к. они обладают значительно большим коэффициентом объемного расширения по сравнению с жидкостями и твердыми телами.
Для однозначного определения состояния вещества вводятся физические характеристики состояния вещества - параметры состояния.
Параметры состояния могут быть интенсивными и экстенсивными. Интенсивные параметры не зависят от количества вещества, экстенсивные - зависят. Пример - объем и температура.
Экстенсивные параметры, отнесенные к единице количества вещества, приобретают смысл интенсивных. Их называют удельными.
Термодинамические параметры состояния - интенсивные свойства, определяющие состояние тела или группы тел.
Обычно состояние однородного тела может быть однозначно определено тремя параметрами - давлением, температурой и удельным объемом.
При наличии силовых полей (гравитационного, электромагнитного и др.) состояние определяется неоднозначно.
1.6. Давление.
Давление - сила, действующая на единицу поверхности тела по нормали к этой поверхности.
[р] = Па = 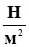
1 Па величина сравнительно небольшая. Поэтому вводят кратные величины
1 кПа = 103 Па = 103 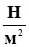 ; 1 кПа = 1
; 1 кПа = 1 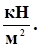
1 МПа = 106 Па = 103 кПа
1 бар = 105 Па = 102 кПа
Внесистемные единицы
1 мм Нg » 133.3 Пa.
1 мм вод. ст. » 9.81 Па.
Виды давления
1. Абсолютное, т.е. полное давление, отсчитываемое от абсолютного вакуума.
Обозначение - рабс.
2. Атмосферное (барометрическое) - абсолютное давление атмосферы Земли в данной точке
рабс = В.
3. Избыточное давление - разность между абсолютным и атмосферным. Параметром состояния не является.
pизб = pабс – B.
Избыточное давление иногда называют манометрическим (т.к. измеряется манометрами).
4. Вакууметрическое давление - разность между атмосферным и абсолютным.
pвак = B - pабс.
Температура характеризует тепловое состояние тела - степень "нагретости" тела.
Температура - осредненная величина кинетической энергии хаотического движения молекул.
Температура, при которой полностью прекращается движение молекул, принята за начало отсчета. Температура тройной точки воды принята равной 273, 16 К (0, 010С).
[T]=K - единица измерения абсолютной температуры.
Температуру часто измеряют по шкале Цельсия.
[t]= °C - единицы измерения температуры в обеих шкалах численно равны.
Температура по шкале Цельсия термодинамическим параметром состояния не является.
T=t+273,15;
t =T-273,15.
Необходимо отметить, что Dt=DT.
За рубежом иногда пользуются шкалами температур Фаренгейта, Реомюра и Ренкина.
1.8. Удельный объем.
Удельный объем - объем единицы массы газа.
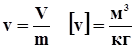
Плотность - величина обратная удельному объему.
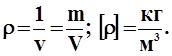
1.9. Уравнение состояния идеального газа Менделеева-Клапейрона
Идеальный газ - модель газа, в которой молекулы не имеют объема и не взаимодействуют друг с другом.
Совместное рассмотрение законов Бойля-Мариотта и Гей-Люссака позволило Клапейрону в 1834 г. вывести уравнение состояния идеального газа.
pv=RT - уравнение для 1 кг газа (уравнение Клапейрона),
где R - газовая постоянная.
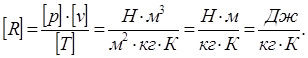
pV=mRT - уравнение для газа массой m.
pVm=mRT - уравнение для 1 киломоля газа (уравнение Менделеева).
V m - объем киломоля газа.
mR=8315 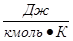 - универсальная газовая постоянная.
- универсальная газовая постоянная.
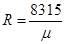 - формула для вычисления газовой постоянной.
- формула для вычисления газовой постоянной.
1.10. Особенности реальных газов. Уравнение состояния реальных газов Ван-дер-Ваальса
Уравнение состояния идеального газа можно применять в расчетах для реактивных газов при низких давлениях и высоких температурах. При нормальных условиях оно применимо для H2, He, O2, N2.
Углекислый газ (СО2) и некоторые другие дают отклонение до 2-3%.
Уравнение состояния реальных газов, учитывающие размер молекул, силы взаимодействия между ними, образование комплексов молекул (ассоциаций) и пр. имеют сложный вид.
В практике обычно используются таблицы и номограммы, построенные на основе этих уравнений.
В общей форме в 1937-46 г. в СССР (Н.Н.Богомолов) и США (Дж.Мейер) были выведены уравнения состояния реальных газов.
Наиболее простым, качественно правильно отображающим поведение реальных газов, является уравнение Ван-дер-Ваальса (1873 г.).
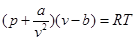 ,
,
где b - поправка на объем молекул газа;
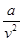 - поправка на давление газа, учитывающая силы взаимодействия молекул.
- поправка на давление газа, учитывающая силы взаимодействия молекул.
Уравнение Ван-дер-Ваальса позволяет качественно анализировать поведение газов вблизи границ фазовых переходов.
1.11. Смеси идеальных газов. Законы Дальтона и Амага
Парциальное давление - давление отдельного компонента смеси газов.
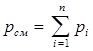 - закон Дальтона
- закон Дальтона
Абсолютное давление смеси газов равно сумме парциальных давлений компонентов смеси.
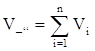 - закон Амагá
- закон Амагá
Полный объем смеси газов равен сумме приведенных к давлению и температуре смеси объемов компонентов (парциальных объемов).
Законы Дальтона и Амагá позволяют получить уравнение состояния смеси газов.
pсмVсм=mсмRсмTсм,
где 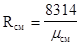 .
.
Кажущаяся молярная масса смеси определяется из уравнения
,
где ri - объемные доли компонентов смеси.
Пример: Полагая, что в воздухе 80% N2 и 20% О2 получаем
mвозд = 0,8 × 28 + 0,2 × 32 = 28,8 кг/моль
Газовая постоянная смеси может быть установлена из уравнения
,
где gi - массовые доли компонентов смеси.
Соотношение между массовыми и объемными долями определяется выражением
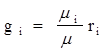 ,
,
где ri - объемные доли компонентов смеси.
Следует отметить, что всегда
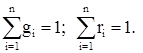
3.Понятие о реальном газе. Уравнение состояния Ван-дер-Ваальса.
1.10. Особенности реальных газов. Уравнение состояния реальных газов Ван-дер-Ваальса
Уравнение состояния идеального газа можно применять в расчетах для реактивных газов при низких давлениях и высоких температурах. При нормальных условиях оно применимо для H2, He, O2, N2.
Углекислый газ (СО2) и некоторые другие дают отклонение до 2-3%.
Уравнение состояния реальных газов, учитывающие размер молекул, силы взаимодействия между ними, образование комплексов молекул (ассоциаций) и пр. имеют сложный вид.
В практике обычно используются таблицы и номограммы, построенные на основе этих уравнений.
В общей форме в 1937-46 г. в СССР (Н.Н.Богомолов) и США (Дж.Мейер) были выведены уравнения состояния реальных газов.
Наиболее простым, качественно правильно отображающим поведение реальных газов, является уравнение Ван-дер-Ваальса (1873 г.).
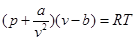 ,
,
где b - поправка на объем молекул газа;
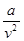 - поправка на давление газа, учитывающая силы взаимодействия молекул.
- поправка на давление газа, учитывающая силы взаимодействия молекул.
Уравнение Ван-дер-Ваальса позволяет качественно анализировать поведение газов вблизи границ фазовых переходов.
4.Теплоемкость, виды теплоемкостей. Теплоемкость смесей газов.
1.12. Теплоемкость газов и газовых смесей. Истинная, средняя и удельная теплоемкость. Зависимость теплоемкости от температуры
Теплоемкость - количество тепла, необходимое для нагрева тела на 1 К.
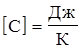
Удельная теплоемкость - количество тепла, необходимое для нагрева единицы количества вещества на 1К.
Обычно различают следующие удельные теплоемкости:
1. Массовая - c
[c] = 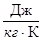
2. Объемная - с'
[c'] = 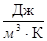
Объем газа при этом должен быть приведен к нормальным условиям.
3. Мольная - mс, где m - молекулярная масса.
[mc] = 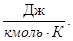
Истинная теплоемкость определяется следующим аналитическим выражением
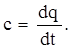
Средняя теплоемкость в интервале температур t1 - t2 определяется из соотношения
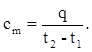
 |
В общем случае теплоемкость является функцией температуры, причем обычно она возрастает с ростом температуры.
На рис.1.1 показана линейная зависимость удельной теплоемкости от температуры, на рис.1.2 - степенная.
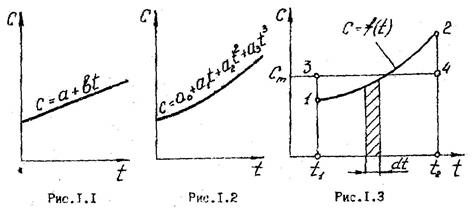
Если зависимость теплоемкости от температуры имеет сложный нелинейный характер (как это показано на рис.1.3), то средняя теплоемкость в интервале температур t1-t2 определяется из выражения:
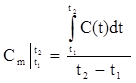 .
.
В справочной литературе обычно приводятся значения истинной теплоемкости при различных температурах, либо средние значения теплоемкости в интервале температур 00С до t0C.
Тогда среднее значение теплоемкости в интервале температур от t1 до t2 определяется выражением:
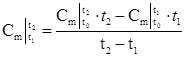
Эта формула применяема к массовой, объемной и мольной теплоемкостям.
Нагрев газов или паров может осуществляться при различных условиях. Среди них можно выделить:
1. Нагрев при постоянном объеме.
2. Нагрев при постоянном давлении.
 В первом случае теплоемкость процесса называют изохорной, во втором - изобарной.
В первом случае теплоемкость процесса называют изохорной, во втором - изобарной.
 | |||
 |


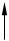
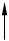




 V=Const p=Const
V=Const p=Const
qv = сVDt qp = сPDt
Во втором случае требуется подвод большего количества тепла, чем в первом, т.к. в процессе подвода теплоты при постоянном давлении совершается работа против внешних сил.
qv < qp.
Тогда соответственно с v < сp
Изобарная и изохорная теплоемкости связаны уравнениями:
сp - сv = R – уравнение Майера;
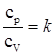 - уравнение Пуассона,
- уравнение Пуассона,
где k - коэффициент Пуассона.
Для одноатомных газов k=1,67 (5/3);
для двухатомных газов k=1,40 (7/5);
для трехатомных и многооатомных газов k=1.33 (4/3).
Теплоемкость газовых смесей вычисляется на основе уравнения теплового баланса, из которого следует:
1. Для массовой теплоемкости смеси: 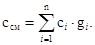
2. Для объемной теплоемкости смеси: 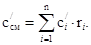
5.Теплота и работа. Основные понятия и определения.
2.1 Теплота и работа
Энергия - единая скалярная мера различных форм движения материи. Характеризует способность систем совершать работу.
Теплота - энергия хаотического движения и взаимодействия частиц тел. Теплота является микрофизической формой передачи энергии от однонго тела к другому при наличии разности температур между ними, причем при этом имеет место обмен кинетической энергией между молекулами соприкасающихся тел, либо перенос тепла электромагнитными волнами.
Работа - макрофизическая форма передачи энергии, связанная с преодолением внешних силовых полей, либо сил давления.
2.2. Внутренняя энергия
В технической термодинамике считают, что внутренняя энергия включает:
1. Кинетическую энергию поступательного, вращательного и колебательного движения молекул.
2. Потенциальную энергию взаимодействия молекул (для реальных газов).
В более широком смысле внутренняя энергия включает также внутриатомную (например, энергию движения электронов), внутриядерную энергию и др. В термодинамике эти виды энергии не рассматриваются.
Для идеальных газов силы взаимодействия между молекулами приняты равными нулю, поэтому u = u(T) - внутренняя энергия является однозначной функцией температуры.
Размерность удельной внутренней энергии 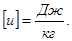
В технической термодинамике знания абсолютного значения внутренней энергии не требуется.
Обычно в технической термодинамике внутреннюю энергию отсчитывают от 0°С, а в теоретической - от 0 К - абсолютного нуля температур.
Для бесконечно малых изменений температуры в каком-либо процессе
du=cV•dT.
После интегрирования получим
u=u2-u1=cV(T2-T1).
Отсюда следует, что изменение внутренней энергии не зависит от пути процесса, а полностью определяется начальным и конечным состояниями.
2.3. Работа расширения рабочего тела
При подводе тепла к рабочему телу в общем случае помимо изменения его внутренней энергии может совершаться работа.
Элементарная работа, отнесенная к 1кг рабочего тела (удельная работа) определяется из соотношения
d l = pdv - элементарная работа расширения.
На рис.2.1 в качестве примера показан цилиндр с поршнем. При перемещении поршня из положения А в положение В совершается работа расширения газа, определяемая из соотношения
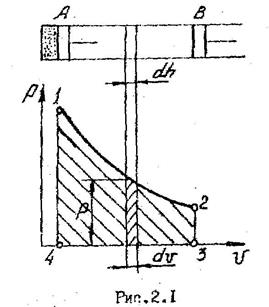
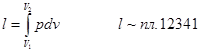
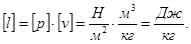
Работа расширения принимается положительной, сжатия - отрицательной.
Численно работа пропорциональна площади под кривой процесса.
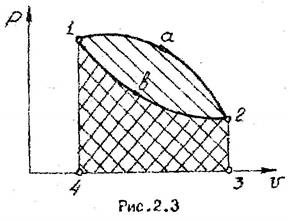
Для тела произвольной формы при изменении его объема (см.рис. 2.2) работа изменения объема составит
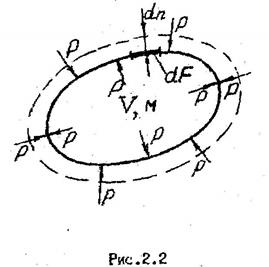
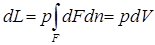 .
.
 Соответственно, если масса тела m, то
Соответственно, если масса тела m, то
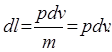
Работа зависит от пути процесса. В качестве примера можно рассмотреть работу процессов 1а2 и 1в2, показанных на рис. 2.2. Из рисунка видно, что l1a2>l1в2 т.к. пл. 1а2341 > пл. 1в2341
Работа расширения (сжатия) является функцией процесса.
6.Внутренняя энергия. Работа расширения газа, pv-диаграмма.
2.4. Первый закон термодинамики.
Первым законом термодинамики называют закон сохранения и превращения энергии (применительно к термодинамическим процессам).