dq=du+d l - 1-й закон термодинамики в дифференциальной форме
Каждый из членов этого уравнения может иметь любой знак.
Правило знаков для теплоты. Подведенное тепло – принимается положительным, отведенное - отрицательным.
Увеличение внутренней энергии - положительная величина, уменьшение - отрицательная.
dq=du+pdv - первая форма записи 1-го закона термодинамики
В интегральной форме
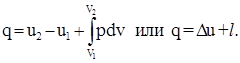
2.5. Энтальпия и энтропия
Дж. У. Гиббс предложил ввести термодинамическую функцию, имеющую смысл полной (внутренней и внешней) энергии системы в виде
i=u+pv - энтальпия (теплосодержание).
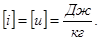
Рассмотрим выражение 1-го закона термодинамики
dq=du+pdv=du+pdv+vdp-vdp=du+d(pv)-vdp=d(u+pv)-vdp.
В результате получаем
dq=di-vdp - вторая форма записи 1-го закона термодинамики.
В интегральной форме 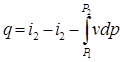 - для конечных изменений состояния рабочего тела.
- для конечных изменений состояния рабочего тела.
Если давление в процессе p=Const, то qp=i2-i1.
С другой стороны qp=cp(T2-T1). Следовательно,Di=cpDT и, соответственно, di=cpdT.
Изменение энтальпии газа равно количеству тепла, подведенному к газу при постоянном давлении.
Энтальпия складывается из внутренней энергии рабочего тела (u) и работы введения рабочего тела объемом v в среду с давлением p.
Название «энтальпия» введено в 1909 г. Каммерлинг-Онессом.
Энтропия. В 1852 г. Р. Клаузиус предложил ввести параметр, зависящий от количества подведенной теплоты, и характеризующий изменение состояние рабочего тела.
Для удобства рассмотрения многих термодинамических процессов вводится понятие энтропии - приведенной теплоты.
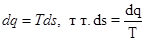 - формально энтропию можно рассматривать как функцию, полный дифференциал которой определяется приведенным выражением.
- формально энтропию можно рассматривать как функцию, полный дифференциал которой определяется приведенным выражением.
Очевидно, что если тепло подводится (dq>0), то энтропия возрастает, если отводится - то энтропия убывает. Энтропия не может быть измерена непосредственно, либо косвенным путем. Ее величину определяют в результате расчета
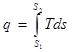 - теплота процесса.
- теплота процесса.
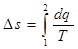 - изменение энтропии в процессе. Последнее выражение непосредственно применяется для вычислений изменений энтропии в термодинамических процессах.
- изменение энтропии в процессе. Последнее выражение непосредственно применяется для вычислений изменений энтропии в термодинамических процессах.
8.Вторая форма первого закона термодинамики. Энтальпия.
2.5. Энтальпия и энтропия
Дж. У. Гиббс предложил ввести термодинамическую функцию, имеющую смысл полной (внутренней и внешней) энергии системы в виде
i=u+pv - энтальпия (теплосодержание).
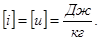
Рассмотрим выражение 1-го закона термодинамики
dq=du+pdv=du+pdv+vdp-vdp=du+d(pv)-vdp=d(u+pv)-vdp.
В результате получаем
dq=di-vdp - вторая форма записи 1-го закона термодинамики.
В интегральной форме 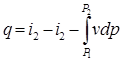 - для конечных изменений состояния рабочего тела.
- для конечных изменений состояния рабочего тела.
Если давление в процессе p=Const, то qp=i2-i1.
С другой стороны qp=cp(T2-T1). Следовательно,Di=cpDT и, соответственно, di=cpdT.
Изменение энтальпии газа равно количеству тепла, подведенному к газу при постоянном давлении.
Энтальпия складывается из внутренней энергии рабочего тела (u) и работы введения рабочего тела объемом v в среду с давлением p.
Название «энтальпия» введено в 1909 г. Каммерлинг-Онессом.