Порезультатам теста АЧТВ определяют дефицит факторов внутреннего пути свертывания, наличие в крови ингибиторов этих факторов и антикоагулянтов. Тест используется для диагностики и дифференциальной диагностики гемофилии, для выявления волчаночного антикоагулянта, при выборе антикоагулянта и для контроля за лечением больных с коронарной недостаточностью.
Тест не улавливает нарушения в тромбоцитах, недостаточность проконвертина, фибринстабилизирующего фактора и недостаток кальция в системе.
Удлинение теста АЧТВ может быть вызвано:
- синдромом диссеминированного внутрисосудистого свертывания (ДВС);
- заболеванием печени, где синтезируются почти все факторы свертывания крови;
- массивными гемотрансфузиями;
- введением гепарина;
- дефицитом факторов внутреннего пути свертывания;
- дефицитом витамина К;
- присутствием ингибиторов свертывания, как специфических, так и неспецифических;
- наличием волчаночного антикоагулянта;
- наличием гемофилии.
Укорочение теста АЧТВ свидетельствует о гиперкоагуляции и опасности возникновения тромбозов.
ПРОТРОМБИНОВОЕ ВРЕМЯ
Протромбиновое время (ПВ) или тест Quick оценивает факторы свертывания за исключением факторов XII, XI, IX, VIII.. Методика его была предложена в 1935 году A. Quick и соавт. и получила распространение под названием "время по Квику" или "тест по Квику". Суть исследования заключается в том, что добавление к бестромбоцитной цитратной плазме тромбопластина (тканевого фактора), полученного из тканей мозга, легких, плаценты млекопитающих или рекомбинантного, в условиях рекальцификации (введение ионов кальция взамен блокированных цитратом) активирует фактор VII, запуская коагуляционный каскад. Последующая активация факторов X и V способствует переходу протромбина в активную форму - тромбин (фактор Па), коагулирующий фибриноген.
Согласно международным требованиям, используемый тромбопластин должен быть стандартизован фирмой-изготовителем и иметь следующие характеристики:
1) Активность (время образования сгустка) на контрольной нормальной плазме должна определяться в пределах от 11 до 14 секунд;
2) Препарат тромбопластина должен быть растворимым, т.е. приготавливаться (без растирания) простым разведением сухого реагента дистиллированной водой или раствором хлорида кальция, или, что предпочтительно, быть готовым к употреблению;
3)Тромбопластин должен иметь на маркировке или в спецификации международный индекс чувствительности (МИЧ или International Sensitivity Index- ISI), который получается при сопоставлении томбопластина с международным стандартом и характеризует степень чувствительности его к дефицитуфакторов протромбинового комплекса (прежде всего фактора VII). Стандартизация по МИЧ введена Комитетом по стандартизации в Гематологии ВОЗс 1983 года и позволяет свести к минимуму разброс результатов определений протромбинового теста при использовании разных тромбопластинов. МИЧ используемого тромбопластина желательно иметь не выше 1,5. Современные тромбопластины, как импортного, так и отечественного производства, удовлетворяют этим требованиям.
4)Важным является и метод детекции образования сгустка в плазме после добавления реагента. Необходимо использовать для этих целей коагулометры, а не мануальные методы, и придерживаться сочетания прибор-реагент, рекомендованного производителем оборудования.
В связи с тем, что протромбиновое время, определенное на разных тканевых тромбопластинах, может варьировать в зависимости от чувствительности и активности реагента, метода детекции образования сгустка, принято выражать результат протромбинового теста не только в секундах, но и сравнивать его с результатом, полученным на плазме здоровых лиц.
Существует несколько вариантов такого сравнения и представления результатов.
1. Оригинальная методика Quick предполагает построение калибровочного графика по 3-м точкам: протромбиновое время в неразведенной нормальной плазме (100% содержания факторов протромбинового комплекса), в разведении плазмы 1:1 (50% содержания факторов) и в разведении 1:3 (25% содержания факторов). Дальнейшее разведение не рекомендуется в связи со снижением количества фибриногена и фактора V. Соотношение активности факторов в плазме и протромбинового времени имеет зависимость по принципу обратной логарифмической функции. Это позволяет построить график и оценить активность факторов протромбинового комплекса в плазме пациента по протромбиновому времени, определенному с тем же тромбопластином. Оригинальная методика Quick имеет одно неоспоримое преимущество-позволяет получить сведения об активности факторов. Именно этот принцип заложен в основу всех современных коагулометров. Нормальные значения % протромбина по Quick для референтной плазмы – 70-130 %.
2. Второй вариант сравнения предполагает расчет соотношения протромбинового времени исследуемой и нормальной плазмы и выражение результатов в виде протромбинового индекса (ПТИ, используется в России) или протромбинового отношения (ПО, prothrombin ratio, используется за рубежом):
ПТИ = (ПВ нормальной плазмы / ПВ исследуемой плазмы) х 100%
ПО = ПВ исследуемой плазмы / ПВ нормальной плазмы
Такой подход упрощает работу лаборатории, не требует построения калибровочного графика, но имеет совершенно очевидный недостаток: эти показатели отражают не активность факторов, а только математическое соотношение двух временных величин. Нормальное значение ПТИ для референтной плазмы - 93-107%, ПО - 0,7-1,1. При снижении активности факторов удлиняется протромбиновое время исследуемой плазмы и в соответствии с этим меняется расчетный показатель: % по Quick, ПТИ уменьшаются, ПО увеличивается. Однако степень изменения может значительно отличаться при использовании различных тромбопластинов, способов детекции и затруднять сопоставление результатов, полученных в разных лабораториях, а снижение ПТИ не всегда коррелирует со снижением % протромбина по Quick.
3. Современный подход к оценке результатов протромбинового теста для больных, получающих антикоагулянты непрямого действия (АНД), предполагает использование тромбопластина, отвечающего описанным выше требованиям, с последующим расчетом показателя международного нормализованного отношения (MHO):
MHO = (ПВ исследуемой плазмы / ПВ нормальной плазмы)мич
MHO - это то значение протромбинового отношения, которое было бы получено для данного образца плазмы при использовании в качестве тромбопластина международного стандарта ВОЗ, индекс чувствительности которого принят за 1,0. Такой подход сделал оценку протромбинового теста стандартизованной, позволил выработать рекомендации по проведению терапии АНД и при ее контроле у конкретного больного получать в разных лабораториях (или водной лаборатории, но в динамике) сопоставимые результаты. Значение MHO для референтной плазмы < 1,3.
За последние годы каждый из приведенных вариантов расчета нашел свое место и должен использоваться в соответствующих ситуациях: % протромбина по Quick (желательно), ПТИ, ПО - в скрининге, MHO - для подбора дозы АНД и контроля такой терапии. Современные коагулометры, все шире использующиеся в лабораториях, предоставляют результаты в секундах, единицах MHO и в % по Quick.
Укорочение протромбинового времени встречается редко и не имеет самостоятельного диагностического значения за исключением, например, контроля за лечением ингибиторной формы гемофилии концентратом активированного фактора VII. Такой подход к оценке результатов исследования привел к тому, что некоторые ведущие мировые производители реагентов (например, Diagnostica Stago) в разделе «Референсный интервал» для тканевого тромбопластина указывает- (>70%), не обозначая верхней границы.
Клинически более значимо и чаще всего встречается удлинение протромбинового времени последующим причинам:
1. Нарушение белково-синтетической функции печени и синтеза факторов протромбинового комплекса. Одновременно снижается фракция альбуминов в сыворотке крови;
2. Нарушение процесса карбоксилирования и синтез нефункциональных факторов свертывания - PIVKA - при любых причинах дефицита витамина К (прием АНД, снижение поступления из кишечника при синдроме малабсорбции, антибиотикотерапии, механической желтухе, дефицитной диете и т.д.);
3. Чрезмерное потребление факторов свертывания при остром синдроме ДВС;
4. Редко встречающийся изолированный врожденный дефицит факторов протромбинового комплекса – VII, X, V или II;
5. Присутствие в пробе гепарина (в значительном количестве);
6. Присутствие продуктов деградации фибриногена и фибрина.
Пролонгированная фармакологическая профилактика венозных тромбозов, эмболии и внутрисердечного тромбообразования осуществляется с помощью АНД (варфарин), которые назначаются на длительный срок или пожизненно.
Основные показания к использованию варфарина: первичная и вторичная профилактика венозного тромбоэмболизма (тромбоз глубоких вен и/или ТЭЛА) при любых этиологических факторах их развития, профилактика тромбоэмболических осложнений у больных с фибрилляцией предсердий, с искусственными клапанами сердца. Менее определенными являются показания у больных с ишемической болезнью сердца, мозга и нижних конечностей. Рандомизированные исследования не показали преимущества использования малых доз варфарина перед аспирином в этих случаях. Сочетанное применение обоих препаратов в первичной профилактике ОИМ снижало риск ишемических исходов на 34%, а использование их изолированно - на 22% и 23%, соответственно (Thrombosis Prevention Trial).
Противопоказаниями к использованию варфарина являются:
1. Алкоголизм;
2. Неспособность адекватного контроля приема препарата и дозы;
3. Рецидивирующие ЖК и легочные кровотечения;
4. Геморрагический инсульт в последние 6 месяцев;
5. Расслаивающая аневризма аорты;
6. Инфекционный эндокардит;
7. Злокачественная гипертензия;
8. Почечная недостаточность (креатинин > 140мкмоль/л);
9. Невозможность адекватного лабораторного контроля и контакта с врачом;
10. Беременность в 1 и III триместре.
В течение всего периода приема препарата основным критерием дозирования является уровень MHO. Все другие лабораторные исследования могут давать только дополнительную информацию о состоянии системы свертывания крови. В связи с тем, протромбиновое время не оценивает активность витамин К-зависимого фактора IX, у больного, получающего АНД, можно переодически определять и АЧТВ, которое должно удлиняться, но не более чем в два раза. Однако в стандарты и рекомендации по контролю за АНД определение АЧТВ не включено. Частота исследования MHO зависит от сроков использования препарата и индивидуальной реакции пациента. Рекомендуемая степень гипокоагуляции зависит от показаний к приему препаратов и обычно соответствует уровню MHO 2,0-3,0. В ряде случаев требуется более выраженная гипокоагуляция - при наличии ИКС (с учетом модели клапанного протеза, его позиции, количества протезированных клапанов и сопутствующих факторов риска развития тромбоза), антифосфолипидного синдрома рекомендуемый уровень MHO 2,5-3,5.
В 2006 году впервые появились рекомендации, одобренные тремя международными ассоциациями (Американский Колледж Кардиологов, Американская Ассоциация Сердца и Европейское Общество Кардиологов) для больных с фибрилляцией предсердий, в которых указывалось: у больных 75 лет и старше при наличии повышенного риска кровотечений, без явных противопоказаний к приему АНД или при умеренных факторах риска ТЭО и неспособности безопасно поддерживать уровень антикоагуляции МНО=2,0-3,0, возможно поддерживать MHO на уровне 1,6-2,5 с достаточной степенью эффективности.
Тактика терапии в конкретных клинических ситуациях:
В терапии АНД можно выделить два периода: период подбора (индукции) и период поддерживающей дозы. Наиболее ответственным и сложным является период индукции. Эффект приема АНД проявляется в течение нескольких дней. Нагрузочные начальные дозы АНД не используются из-за угнетения компонентов противосвертывающей системы - протеинов С и S.
Терапия начинается со стандартной дозы препарата, указанной производителем. Начальная доза может быть несколько меньше, если у больного есть предпосылки для дефицита витамина К (нарушение желчеотделения и всасывания в кишечнике, необходимость приема конкурирующих препаратов и др.), у истощенных больных, у пациентов с малой массой тела Варфарин, в частности, принимается 1 раз в сутки в 16.00-20.00, а стандартная начальная доза составляет 5 мг.
Если терапия варфарином следует за использованием гепаринов, то назначать препарат необходимо, сохраняя введение НФГ или НМГ до тех пор, пока не будет получено подряд 2 значения MHO в терапевтическом интервале, то есть >2,0 (так называемая переходная тактика или bridging - мост). Только тогда гепарин может быть отменен (сразу, без снижения дозы).
Для достижения максимального эффекта АНД может понадобиться до 4-7 дней. Однако некоторые больные достигают гипокоагуляции в течение 2-3 суток, поэтому первое исследование MHO должно быть выполнено не позднее, чем через 36 часов после приема первой дозы препарата. В период индукции MHO необходимо определять не реже 1 раза в 1-2 дня до тех пор, пока не будет достигнут желаемый подъем MHO и 2 следующих друг за другом результата не будут одинаковыми. Далее исследование выполняется 1 раз в неделю, а после 1 месяца стабильности - 1 раз в месяц.
По результатам исследования во 2 день больные могут быть разделены на 3 группы. Правомочность такого деления подтверждается и дальнейшим наблюдением не только в период индукции, но и в период поддерживающей дозы:
I группа - больные с высокой чувствительностью к варфарину. Они быстро достигают терапевтического значения MHO при стандартном начале терапии,часто дают чрезмерную гипокоагуляцию даже при внимательном их ведении и тщательном лабораторном контроле, имеют значительные и немотивированные колебания MHO в период поддерживающей дозы, медленно восстанавливают свертывающую способность при отмене препарата или уменьшении дозы.
II группа - больные с обычной чувствительностью к препарату составляют большую часть пациентов. Они достигают терапевтического значения MHO на 5-6 сутки терапии, имеют предсказуемый ответ на увеличение или уменьшение дозы, стабильны в период поддерживающей дозы.
III группа - больные со сниженной чувствительностью к варфарину, иногда они называются варфарин-резистентными. Для них характерно медленное нарастание MHO, «ригидность» при попытке изменить дозу и быстрое восста новление после отмены препарата.
Больные первой группы составляют небольшую часть от лиц, принимающих варфарин. Как правило, это пациенты, имеющие мутации гена цитохрома 2С9 (CYP2C9) семейства Р-450, который метаболизирует варфарин. При генотипе с включением аллелей *2 и *3 фермент обладает сниженной каталитической активностью, а у больного имеет место высокая чувствительность к варфарину, особенно в сочетании с другими лекарственными препаратами, метаболизируюшимися тем же ферментом - нестероидные противовоспалительные средства, ингибиторы рецепторов к ангиотензину. Проведение молекулярно-генетического анализа и определение генотипа по CYP2C9 позволяет прогнозировать чувствительность к варфарину, объяснять нестабильность ответа на прием препарата, ориентировочно определять интервал дозирования для достижения терапевтического значения MHO, предвидеть опасность геморрагических осложнений (Сироткина О.В. с соавт., 2005). Но подбор дозы может осуществляться только по функциональному ответу системы гемостаза на прием варфарина, то есть - по уровню MHO.
Принцип дозирования препарата во второй группе пациентов с обычной чувствительностью к варфарину стандартный: увеличение дозы до момента достижения терапевтического значения MHO. В случае превышения 4,0 - отмена препарата на 1 сутки, продолжение терапии сниженной дозой варфарина. Большая часть больных принадлежит именно к этой группе.
В случае сниженной чувствительности к препарату достижение МНО=2,0 происходит медленнее, дозу приходится увеличивать активнее, сроки подбора терапии затягиваются (III группа)
Необходимо соблюдать осторожность при при одновременном с варфарином приемом ацетилсалициловой кислоты, препаратов для лечения менструальных болей и ревматических заболеваний, других лекарственных препаратов. Взаимодействие фармакологических препаратов с АНД представлено в таблице. Назначение этих лекарственных средств должно согласовываться с лечашим врачом.
Наиболее актуальным является назначение варфарина и антиагрегантов. Сочетанное использование этих препаратов оправдано патогенетическими механизмами активации свертывания и разными точками приложения их действия. Активированные тромбоциты являются поверхностью, на которой образуются основные комплексы активации плазменного гемостаза - теназный и протромбиназный. Снижение тромбиновой активности при использовании НМГ или АНД ведет и к снижению активности тромбоцитов, однако не всегда такого эффекта удается добиться. В таких случаях, обычно у больных с ИКС или фибрилляцией предсердий, к приему варфарина приходится добавлять аспирин. В то же время при артериальных тромбозах (атеротромбоз коронарных артерий) нередко используется варфарин, например, при развитии Q-инфаркта с зоной гипокинезии или формированием аневризмы (из-за опасности внутрисердечного тромбообразования). Описаны случаи использования не только аспирина, но и плавикса в сочетании с АНД.
Таблица 3
Взаимодействие лекарственных препаратов с АНД
| Усиливают активность ОАКOAK | Снижают активность | ||
| Аллопуринол | Диазоксид | Налидиксо- вая кислота | Антациды |
| Аминодарон | Омепразол | Антигистаминные препараты | |
| Анаболические | Ранитидин | Барбитураты (и барбитурат-со- | |
| стероиды | Симвастатин | Пиразолон | держащие прпараты - корвалол, |
| Аспирин | Стрептокиназа | Тиреоидные гормоны | валокордин, андипал и др.) |
| Ацетаминофен | Сульфаниламиды | Галоперидол | |
| Клофибрат | Гризеофульвин | ||
| Хлоралгидрат | Тамоксифен | Урокиназа | Мепробамат |
| Цефокситин | Тиклопидин | Оральные контрацептивы | |
| Циметидин | Толбутамид | Сукральфат | |
| Хинидин | Холестирамин Циклоспорин |
Антикоагулянтная терапия у пациентов пожилого и детского возраста проводится по тем же принципам, но с учетом как поведенческих особенностей больных - подвижность, невнимательность детей, недооценка ими опасности, забывчивость пожилых, наличие сопутствующей патологии и терапии. В то время как для взрослых пациентов разработаны строгие рекомендации по диагностике, терапии и профилактике тромботических осложнений,
В настоящее время остается не решенным окончательно и вопрос о приеме АНД во время беременности. До недавнего времени большинство исследователей придерживалось той точки зрения, что прием АНД беременным противопоказан в связи с возможным эмбриотоксическим действием и развитием патологии плода. При получении информации о беременности АНД должны быть немедленно заменены на препараты НМГ. За 24 часа до планового родоразрешения гепарин отменяют. С.Л. Дземешкевич и Е.П. Панченко (2001) приводят иные протоколы ведения таких пациенток: без отмены АНД и с переходом на препараты гепарина только в течение первого триместра беременности и за 2 недели до родов. Z. Ashour и соавт. (2000) наблюдали 100 беременных женщин с протезами сердечных клапанов, у которых родились здоровые дети в 57,8% и в 52,9% случаев в соответствии с этими протоколами. Часто женщина обращается с вопросом об отмене или сохранении терапии варфарином уже в конце 1 триместра, а врачи не имеют достаточных сведений и опыта в ведении таких пациенток. В каждом случае вопрос об антитромботической профилактике у беременной должен решаться индивидуально. Однако она должна быть полностью информирована как об опасности использования антикоагулянтов для ребенка, так и о повышенном риске тромбозов для нее самой в ходе беременности, особенно у женщин с механическими искусственными клапанами сердца. Окончательное решение о сохранении или прерывании беременности принимает женщина и ее семья. На основании этого решения и оценки степени риска тромбозов, геморрагии и тератогенного эффекта строится программа антитромботической профилактики.
Пациенты, получающие АНД, должны правильно строить свою диету и соблюдать режим питания. Каждую неделю пациент должен съедать одинаковое количество овощей для того, чтобы не изменять количество витамина К, поступающего с пищей. Необходимо ограничить прием или исключить из питания продукты с высоким содержанием витамина К учитывая в расчетах не только содержание его в 100 г продукта, но и в потребляемой порции, например, 200 г тыквы содержит больше витамина К, чем чашка зеленого чая. Рекомендуются продукты, содержащие углеводы и белки, а также природные антиагрегируюшие агенты - скумбрия, карп, треска.
Можно позволить себе бокал вина один или два раза в неделю. Превышение этой нормы потребления алкоголя приведет к повышению MHO и повысит риск кровотечения.
Самым опасным осложнением терапии непрямыми антикоагулянтами является развитие кровотечений, частота которых колеблется от 0,9 до 2,7%.
Предотвратить геморрагические осложнения можно только при правильном и своевременном лабораторном контроле терапии с учетом факторов риска кровотечений:
- возраст старше 75 лет;
- наличие в анамнезе желудочно-кишечного кровотечения;
- артериальная гипертензия с диастолическим АД более 110 мм рт.ст.;
- цереброваскулярные заболевания;
- почечная и печеночная недостаточность;
- алкоголизм;
- злокачественные новообразования;
- совместно принимаемые антиагрегантные препараты и антикоагулянты.
Увеличение MHO более 4,0 опасно развитием геморрагических осложнений. Если клиническая ситуация не требует такой выраженной гипокоагуляции, то препарат должен быть отменен (!) на 1 сутки, а затем доза его должна быть снижена с внеочередным контролем MHO после ее коррекции. Развившееся кровотечение может быть купировано введением свежезамороженной плазмы или использованием препаратов витамина K1 (не викасола!) (табл.16).
Таблица 4
Рекомендации по ведению больных с геморрагическими осложнениями Варфаринотерапии
| Уровень! Осложнения | Рекомендации | |
| 1ССерьезные кровотечения, MHO повышено | Отмена варфарина. Вит. Ki 10 мг в/в медленно (повтор через 12 часов), СЗП, концентрат протромбинового комплекса или рекомбинантный фактор Vila - rVlla | |
| 1С | Жизнеугрожаю-щие крвотечения, MHO повышено | Отмена варфарина, концентрат протромбинового комплекса, rVIIa. Вит. К] Ш мг в/в медленно (повтор через 12 часов) |
| 1А | Умеренное повышение MHO, большого кровотечения нет | Витамин Ki per os, но не подкожно |
Во всех случаях, когда терапия АНД должна быть прервана, необходимо соотнести риск развития тромбозов и кровотечений и в соответствии с конкретной ситуацией построить тактику.
При малом риске кровотечения и низком риске тромбоза небольшие оперативные вмешательства (экстракция зуба, гинекологические процедуры) могут быть выполнены на сниженной дозе варфарина и MHO 1,3-1,5. Такая интенсивность гипокоагуляции безопасна для проведения небольших операций, что было доказано в рандомизированных исследованиях.
При умеренном или высоком риске тромботических осложнений необходимо отменить варфарин за 4 дня до операции, а за 2 суток начать введение НФГ или НМГ в профилактической или терапевтической дозировке. Далее -отмена гепарина за 12-24 часа до вмешательства и возобновление его введения через 12 часов при отсутствии риска кровотечения. Со вторых суток - возвращение к варфарину в подобранной дозе. Дальнейшая тактика bridging-терапии стандартна. Если операция сама по себе несет риск тромбоза, то введение НФГ или НМГ (желательно) может быть продлено до 7-14 дней с последующим возвращением к варфарину.
Для систематизации сведений о проведении антикоагулянтной терапии и дисциплинирования самого больного целесообразно ведение дневника, в котором пациент отмечает принятую дозу препарата, результат исследования MHO и делает замечания об изменении диеты, полимедикации и симптомах кровоточивости.
Систему MHO необходимо применять при лечении пациентов, получающих стабильную антикоагулянтную терапию. MHO нецелесообразно использовать для 3 групп больных: при скрининговом исследовании свертывающей системы, у пациентов с нарушением функций печени и у пациентов, только начавших курс лечения пероральными антикоагулянтами.
ТРОМБИНОВОЕ ВРЕМЯ
Определение тромбинового времени является третьим по значимости базисным скрининговым тестом. Тест характеризует конечный этап процесса свертывания - превращение фибриногена в фибрин под действием тромбина, на него влияет концентрация фибриногена в плазме и наличие продуктов деградации фибрина. Удлинение тромбинового времени может быть вызвано молекулярными аномалиями и снижением уровня фибриногена (менее 1,0 г/л), избытком в крови гепарина в результате гепаринотерапии, накоплением продуктов деградации фибрина, парапротеинемией, наследственной и приобретенной дисфибриногенемией, наличием ингибиторов тромбина и фибриногена.
Для дифференциальной диагностики проводят количественное определение фибриногена, продуктов деградации фибрина, пробу с протаминсульфатом и др., позволяющие уточнить диагноз. Образование сгустка не происходит в терминальной стадии ДВС-синдрома, а также при внутривенном введении большой дозы гепарина..
Ключевым реагентом при проведении теста является реагент тромбин, который должен быть выделен в максимально очищенном виде, и сохранять свою активность при выделении и лиофильном высушивании. При проведении тест используют тромбин с активностью 3 МЕ/мл и 6 МЕ/мл. Для исследования плазмы, не содержащей гепарин, как правило, используют тромбин с активностью 3 МЕ/мл. При работе с гепаринизированной плазмой необходимо использовать тромбин с активностью 6 МЕ/мл.
Следует отметить, что при использовании тромбина с активностью 3 МЕ/мл время свертывания должно лежать в диапазоне 16-21 (±5) сек, а при использовании тромбина с активностью 6 МЕ/мл время свертывания должно находится в более узком диапазоне 9-13 (±2) сек.
Таким образом, принято в первом случае считать патологией отклонение от нормы более, чем на 5 сек, во втором случае - на 2 сек.
Принцип метода определения заключается в том, что при добавлении тромбина к цитратной плазме время образования сгустка фибрина зависит только от количества и активности фибриногена в данной плазме, от активности тромбина и от наличия ингибиторов. Реакция проходит в одну стадию
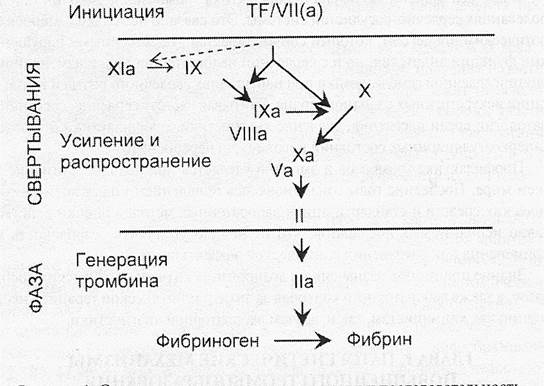 |
Рисунок 1. Стадии процесса свертывания крови и последовательность активации факторов
В соответствии с модифицированной теорией свертывания, которая расширила и дополнила каскадную теорию и была представлена в конце 90-х - начале 2000-х годов, деление процесса образования тромба на внешний и внутренний путь не вполне точно отражает существо развивающихся in vivo событий (Hoffman M., Monroe D.M., 2001; Бутенас С, Манн К.Г., 2002", ПапаянЛ.П., 2003). Предложено рассматривать тромбообразование как трехфазную реакцию, которая начинается с повреждения сосудистой стенки и образования комплекса тканевой фактор:ф.УИа и проходит стадии (1) инициации, (2) усиления и распространения и (3) генерации тромбина и фибрина (рис.1). При этом на стадии инициации образуется малое количество тромбина, а на заключительном этапе возникает, так называемый «тромбиновый взрыв» (thrombin burst). Теназный (ф.VШа:ф.IХа) и протромбиназный (ф.Vа:ф.Ха) комплексы «работают» на поверхности активированных тромбоцитов, которые играют важнейшую роль во всей системе свертывания крови.
Образование тромбина является центральным событием процесса свертывания крови. Небольшое количество ф. Ха, образованное выделившимся при травме тканевым фактором и ф. VIIa, приводит к образованию очень небольшого количества тромбина, которое легко разрушается антитромбином III.
Сигнал сразу усиливается, когда тромбин связывается с тромбоцитами. При этом неактивный ф. V преобразуется в активный ф. Va - кофактор, необходимый для образования комплекса ПРОТРОМБИНАЗЫна активированной мембране тромбоцитов.
Тромбин также высвобождает ф. VIII от связи с фактором Виллебранда и переводит его в ф. VIIIa., который является основным компонентом комплекса ТЕНАЗЫ, который также располагается на поверхности тромбоцитов.
Ф. Па переводит ф. XI в ХIа, что приводит к активации ф. IX в ф. IХа. И, наконец, именно тромбин активирует тромбоциты и тем завершает образование комплексов ТЕНАЗЫи ПРОТРОМБИНАЗЫ.
Укрепление этих комплексов на поверхности тромбоцитов быстро приводит к образованию достаточного количества фIIa для поддержания активации тромбоцитов. Тромбоциты активируются как при прилипании к коллагену, так и под действием тромбина.
Таким образом, небольшое количество тромбина, образованное при повреждении тканевых клеток, с помощью реакций обратной связи и в присутствии тромбоцитов существенно возрастает. Затем при образовании мультиферментных комплексов на поверхности активированных тромбоцитов количество тромбина уже многократно увеличивается и распространяется по всему организму. Конечный результат - образование большого количества тромбина и длительная активация тромбоцитов, что приводит к превращению неактивного и растворимого фибриногена плазмы крови в нерастворимый полимер фибрин.
Тромбин - это витамин К зависимая протеиназа с ММ 37 000 D.. Тромбин имеет много функций: он активирует кофакторы V и VIII, активирует ф. XI, способствует активации, агрегации и дезинтеграции тромбоцитов, активирует ф. XIII, и только тромбин превращает растворимый фибриноген плазмы в нерастворимый фибрин.
Тромбин выделяют из плазмы крови с помощью тромбопластина, который превращает неактивный протромбин плазмы в активный фермент тромбин. Затем следуют этапы хроматографической очистки от примесей, которые значительно повышают удельную активность тромбина. Удобно готовить для анализов 2 раствора тромбина: стабилизированный раствор тромбина, который допускается хранить в течение месяца при температуре 2-8°С и рабочий раствор тромбина, который используется в течение 2 ч в день изготовления.
Интерпретация результатов
Удлинение тромбинового времени происходит при:
гипофибриногенемии, связанной с ДВС или наследственной или приобретенной патологией;
повышенной концентрации продуктов деградации фибриногена/фибрина;
присутствии в крови гепарина;
с парапротеинемией;
с наличием в крови ингибиторов тромбина или фибриногена;.
дисфибриногенемии, связанной с заболеванием печени или при наследственной патологии.
Укорочение тромбинового времени свидетельствует о риске тромбозов. Нормальные значения тромбинового времени:
- тромбин с активностью 6 МЕ/мл -9-12 сек
- тромбин с активностью 3 МЕ/мл - 15-20 сек