В редких случаях степень торможения активности фермента может увеличиваться с повышением концентрации субстрата. Для этого типа торможения был предложен термин "бесконкурентное ингибирование".
Бесконкурентное ингибирование имеет место, когда ингибитор взаимодействует с ферментом только в составе фермент-субстратного комплекса, препятствуя его распаду (Уэбб Л., 1966).
Примером необратимого действия ингибиторов на ферменты могут служить фосфорорганические вещества, применяемые в качестве инсектицидов.
Известно, кроме того, так называемое бесконкурентное ингибирование, когда ингибитор связывается с ферментом также в некаталитическом центре, однако не со свободным ферментом, а только с ES-комплексом в виде тройного комплекса ESI (Т.Т. Березов, Б.Ф. Коровкин, 1990).
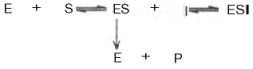
При бесконкурентном ингибировании ингибитор связывается только с фермент-субстратным комплексом, но не со свободным ферментом. Субстрат, связываясь с ферментом, изменяет его конформацию, что делает возможным связывание с ингибитором. Ингибитор, в свою очередь, так меняет конформацию фермента, что катализ становится невозможным
Один из механизмов такого торможения обусловлен возможностью соединения ингибитора с комплексом ES с образованием неактивного или медленно реагирующего тройного комплекса EIS (Т.Т. Березов, Б.Ф. Коровкин, 1990).
Ингибирование субстратом — частный случай бесконкурентного ингибирования, когда две молекулы субстрата связываются с ферментом, что препятствует образованию продукта
Активность многих ферментов тормозится избытком субстрата, причем имеется несколько механизмов этого процесса.
1) Если в образовании фермент-субстратного комплекса участвует несколько функциональных групп фермента, то возможно одновременное присоединение к активному центру двух или более субстратов, что однозначно приведет к образованию неактивного комплекса.
2) В случае избытка субстрата возможно его присоединение не только к активному центру, но и к другим химическим группировкам, функционально связанным с активным центром. Такого рода взаимодействие может помешать ферментативной реакции.
3) Увеличение концентрации субстрата может повысить ионную силу реакционной среды и, как следствие, затормозить скорость ферментативной реакции.
Торможение продуктами реакции связано с тем, что они могут связываться с ферментом или с каким-либо другим компонентом системы таким образом, что скорость прямой реакции снижается.
Необратимое ингибирование
Необратимые ингибиторы связывают или разрушают функциональную группу молекулы фермента, необходимую для проявления его каталитической активности. Происходит формирование стабильного комплекса ингибитора с ферментом, ведущее к его необратимой инактивации. Случай необратимого ингибирования можно обнаружить по тому признаку, что при разбавлении раствора не происходит повышения удельной активности фермента, как в случае обратимого ингибирования.
Примером необратимого ингибитора может служить соединение диизопропилфторфосфат (ДФФ), которое ингибирует фермент ацетилхолинэстеразу, играющий важную роль в передаче нервных импульсов. Ацетилхолинэстераза катализирует гидролиз ацетилхолина, функционирующего в качестве нейромедиатора в определенных отделах нервной системы. Ацетилхолин выделяется стимулированной нервной клеткой в синапс, т.е. место соединения одного нейрона с другим. В синапсе ацетилхолин связывается с рецепторами следующего нейрона, вынуждая его проводить нервный импульс. Однако прежде чем второй импульс будет передан через синапс следующему нейрону, ацетилхолин, выделившийся после первого импульса, должен быть гидролизован ацетилхолинэстеразой в месте соединения нервных клеток. Продукты его распада - ацетат и холин - не способны действовать как нейромедиаторы. Необратимый ингибитор ДФФ, обладающий высокой реакционной способностью, присоединяется к гидроксильной группе остатка серина в активном центре ацетилхолинэстеразы, что приводит к образованию каталитически неактивного производного. В результате фермент перестает функционировать. ДФФ, одно из первых отравляющих веществ нервнопаралитического действия, в опытах на животных вызывает нарушение некоторых функций вследствие того, что пораженные нейроны утрачивают способность проводить нервные импульсы. Однако ДФФ обладает и полезными свойствами. На его основе был создан ряд относительно нетоксичных для людей и животных инсектицидов, например малатион. Сам по себе малатион неактивен и в организме высших животных разлагается на продукты, которые считаются безвредными. В организме же насекомых малатион превращается под действием ферментов в активный ингибитор их собственной ацетилхолинэстеразы.
Выяснилось, что ДФФ ингибирует целый класс ферментов, многие из которых способны катализировать гидролиз пептидов или эфирных связей. К этим ферментам относится не только ацетилхолинэстераза, но и трипсин, химотрипсин, эластаза, фосфоглюкомутаза и коконаза (фермент, выделяемый личинкой тутового шелкопряда и используемый ею для гидролиза шелковых нитей и освобождения из кокона). Характерная особенность всех ферментов, ингибируемых ДФФ, состоит в том, что они содержат в активном центре остаток серина, принимающий участие в каталитическом акте
Другой необратимый ингибитор некоторых ферментов, иодацетамид может взаимодействовать с сульфгидрильными (—SH) группами остатков цистеина или с имидазольными группами остатков гистидина, содержащихся в активных центрах этих ферментов. С помощью таких ингибиторов было установлено, что гидроксильная группа серина, тиоловая группа цистеина и имидазольная группа гистидина участвуют в каталитической активности ферментов, принадлежащих к разным классам.