Министерство сельского хозяйства РФ
ФГОУ ВПО
"Оренбургский государственный аграрный университет"
КУРСОВАЯ РАБОТА
по биохимии на тему:
Ингибирование ферментативной активности
Оренбург – 2010
Содержание
1. Ингибиторы ферментов. Типы ингибирования активности ферментов
1.1 Обратимое ингибирование
1.1.1 Конкурентное ингибирование
1.1.2 Неконкурентное ингибирование
1.1.3 Бесконкурентное ингибирование
1.2 Необратимое ингибирование
1.3 Аллостерическое ингибирование
2. Новый вид ингибирования ферментативной активности
3. Применение ингибиторов ферментов
ЗАКЛЮЧЕНИЕ
Список использованной литературы
1. Ингибиторы ферментов. Типы ингибирования активности ферментов
Известно, что активность ферментов сравнительно легко может быть уменьшена с помощью разнообразных воздействий. Такое снижение скорости ферментативных реакций принято называть торможением активности, или ингибированием ферментов.

Рис 1. Схема активирования и ингибирования действия фермента (по Ю. Б. Филипповичу): а. – аллостерический центр фермента; К - каталитический центр; с - субстратный центр
Ферменты являются белками, соответственно их активность можно снизить или полностью ликвидировать путем воздействий, приводящих к денатурации белков (нагревание, действие концентрированных кислот, щелочей, солей тяжелых металлов и т.п.) Это неспецифическое подавление активности ферментов, имеющее значение при изучении ферментативных реакций, не представляет особого интереса для исследования их механизма. Гораздо большее значение имеет исследование ингибирования с помощью веществ, специфически и обычно в небольших количествах взаимодействующих с ферментами – ингибиторов ферментов. Расшифровка механизмов многих биологических процессов, таких как гликолиз, цикл Кребса и других, стала возможной лишь в результате применения специфических ингибиторов различных ферментов (Н.Е. Кучеренко, Ю.Д. Бабенюк и др., 1988).
Некоторые ингибиторы ферментов являются для организма животных и человека эффективными лекарственными веществами, другие — смертельными ядами (В.П. Комов, В.Н. Шведова, 2004).
Ингибиторы взаимодействуют с активными центрами молекулы фермента, инактивируя функциональные группы белков. Они могут взаимодействовать с металлами, входящими в состав молекул ферментов и фермент-субстратных комплексов, инактивируя их. Высокие концентрации ингибиторов разрушают четвертичную, третичную и вторичную структуры молекулы фермента, вызывая его денатурацию (А.И. Кононский, 1992).
Недавно открыты антиферменты (антиэнзимы, или антизимы), представляющие собой белки, действующие как ингибиторы ферментов. К подобным веществам относятся, например, ингибитор трипсина, обнаруженный в соевых бобах, и сывороточный антитрипсин. Недавно открыт в печени животных антифермент орнитиндекарбоксилазы. Антизимы, вероятнее всего, образуют труднодиссоциируемые комплексы с соответствующими ферментами, выключая их из химических реакций. Иногда ингибитор является составным компонентом предшественника фермента, или входит в состав сложных комплексов ферментов. Однако до сих пор не выяснено, являются ли подобные антиферменты истинными ингибиторами или регуляторными субъединицами.
Если ингибитор вызывает стойкие изменения пространственной третичной структуры молекулы фермента или модификацию функциональных групп фермента, то такой тип ингибирования называется необратимым. Чаще, однако, имеет место обратимое ингибирование, поддающееся количественному изучению на основе уравнения Михаэлиса-Ментен. Обратимое ингибирование в свою очередь разделяют на конкурентное и неконкурентное
На практике многие ингибиторы не проявляют тех свойств, которые характерны для чисто конкурентного или чисто неконкурентного ингибирования. Другой способ классификации ингибиторов основывается на характере места их связывания. Одни из них связываются с ферментом в том же месте, что и субстрат (в каталитическом центре), а другие — на значительном расстоянии от активного центра (в аллостерическом центре) (Р. Марри, Д. Греннер и др., 1993).
Обратимое ингибирование
Различают три типа обратимого ингибирования ферментов: конкурентное, неконкурентное и бесконкурентное, в зависимости от того, удается или не удается преодолеть торможение ферментативной реакции путем увеличения концентрации субстрата.
Конкурентное ингибирование
Конкурентный ингибитор конкурирует с субстратом за связывание с активным центром, но в отличие от субстрата связанный с ферментом конкурентный ингибитор не подвергается ферментативному превращению. Отличительная особенность конкурентного ингибирования состоит в том, что его можно устранить или ослабить, просто повысив концентрацию субстрата. Например, если при заданных концентрациях субстрата и конкурентного ингибитора активность фермента подавлена на 50 %, то мы можем уменьшить степень ингибирования, повысив концентрацию субстрата.
По своей трехмерной структуре конкурентные ингибиторы обычно напоминают субстрат данного фермента. Благодаря такому сходству конкурентному ингибитору удается "обмануть" фермент и связаться с ним. Конкурентное ингибирование можно количественно изучать на основе теории Михаэлиса-Ментен. Конкурентный ингибитор I просто обратимо присоединяется к ферменту Е, образуя с ним комплекс
Е + I = EI.
Конкурентное ингибирование проще всего можно распознать экспериментальным путем, определив влияние концентрации ингибитора на зависимость начальной скорости реакции от концентрации субстрата. Для выяснения вопроса о том, по какому типу - конкурентному или неконкурентному - происходит обратимое ингибирование фермента, используют метод двойных обратных величин. Из графиков, построенных в двойных обратных координатах, можно определить также значение константы диссоциации комплекса фермент ингибитор (см. рис. 1) (А. Ленинджер, 1985)
Конкурентное ингибирование может быть вызвано веществами, имеющими структуру, похожую на структуру субстрата, но несколько отличающуюся от структуры истинного субстрата. Такое ингибирование основано на связывании ингибитора с субстратсвязывающим (активным) центром (см. рис. 2).

Рис. 2. Общий принцип конкурентного ингибирования (схема по В.Л. Кретовичу). Е - фермент; S - субстрат; Р1 и Р2 - продукты реакции; I - ингибитор.
В качестве примера можно привести действие малоновой кислоты на реакцию, которая катализируется сукцинатдегидрогеназой и связана с превращением янтарной кислоты в фумаровую. Добавление малоновой кислоты к реакционной смеси снижает или полностью останавливает ферментативную реакцию, так как она является конкурентным ингибитором сукцинатдегидрогеназы. Сходства малоновой кислоты с янтарной достаточно для образования комплекса с ферментом, однако распад этого комплекса не происходит. При увеличении концентрации янтарной кислоты она вытесняет малоновую кислоту из комплекса, в результате активность сукцинатдегидрогеназы восстанавливается.
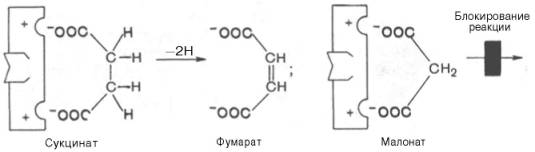
Рис. 3. Конкурентное ингибирование реакции превращения янтарной кислоты в фумаровую под действием малоновой кислоты.
Структуры субстрата (сукцинат) и ингибитора (малонат) все же несколько различаются. Поэтому они конкурируют за связывание с активным центром, и степень торможения будет определяться соотношением концентраций малоната и сукцината, а не абсолютной концентрацией ингибитора. Таким образом, ингибитор может обратимо связываться с ферментом, образуя фермент-ингибиторный комплекс. Этот тип ингибирования иногда называют ингибированием по типу метаболического антагонизма (см. рис. 3).
В общей форме реакция взаимодействия ингибитора с ферментом может быть представлена следующим уравнением:

Образовавшийся комплекс, называемый фермент-ингибиторным комплексом ЕI, в отличие от фермент-субстратного комплекса ES не распадается с образованием продуктов реакции.
Многие лекарственные вещества ингибируют ферменты человека и животных по конкурентному типу. Например, что для лечения некоторых инфекционных заболеваний, вызываемых бактериями, применяют сульфаниламидные препараты. Оказалось, что эти препараты имеют структурное сходство с парааминобензойной кислотой, которую бактериальная клетка использует для синтеза фолиевой кислоты, являющейся составной частью ферментов бактерий. Благодаря этому структурному сходству сульфаниламид блокирует действие фермента путем вытеснения парааминобензойной кислоты из комплекса с ферментом, синтезирующим фолиевую кислоту, что ведет к торможению роста бактерий.

В структуру пептидогликана клеточной стенки бактерий включен D-аланин, отсутствующий в организме животных и человека. Для синтеза клеточной стенки бактерии при помощи фермента аланин-рацемазы превращают L-аланин животных в D-форму. Аланин-рацемаза характерна для бактерий и не обнаружена у млекопитающих. Следовательно, она представляет хорошую мишень для ингибирования лекарственными препаратами. Замещение одного из протонов метильной группы на фтор дает фтораланин, с которым связывается аланин-рацемаза, что приводит к ее ингибированию.
Некоторые аналоги витамина В6 и фолиевой кислоты, в частности дезоксипиридоксин и аминоптерин, действуют как конкурентные, так называемые коферментные, ингибиторы (или антивитамины), тормозящие многие интенсивно протекающие при патологии биологические процессы в организме. Применение подобных аналогов в медицинской практике (в частности, в дерматологии и онкологии) основано на конкурентном вытеснении коферментов из субстратсвязывающих центров ключевых ферментов обмена (Т.Т Березов, Б.Ф. Коровкин, 1990).
Таким образом, можно конструировать лекарственные вещества, ингибирующие ферменты по конкурентному типу. Чтобы быть эффективным, ингибитор должен иметь высокое сродство к ферменту. В противном случае необходимо назначать большие дозы лекарственных препаратов, чтобы активно конкурировать с эндогенным субстратом за активный центр фермента (В.П. Комов, В.Н. Шведова, 2004).