ЭДС гальванического элемента. Что такое. Как определяется. Что влияет. Теория сильных электролитов.
Если пластинку некоторого металла, погруженную в раствор его соли с концентрацией иона металла 1 моль/л, соединить электролитным мостиком с водородным электродом, то получится гальванический элемент, т.е. в полученной системе пойдет электрический ток, обусловленный разностью электродных потенциалов водородного электрода и изучаемого металла.
Вот эту величину — разность электродных потенциалов катода и анода — в разомкнутом (незамкнутом) гальваническом элементе называют электродвижущей силой (ЭДС или Е) элемента: ЭДС = ∆φ1 –∆φ2 или ЭДС = ∆φк –∆φА




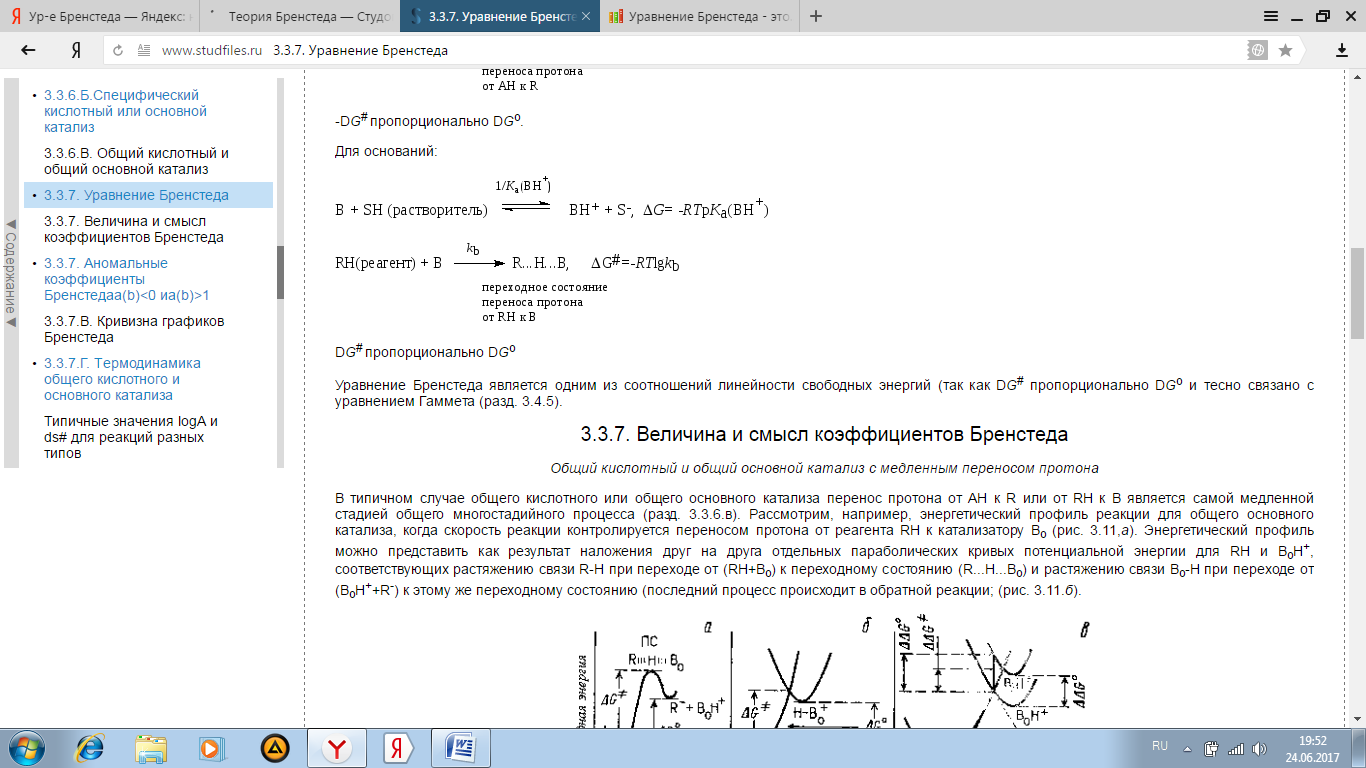
Кинетические реакции в р-рах. Ур-е Бренстеда и солевой эффект.
Кинетика – раздел химии, изучающий протекание реакции во времени, зависимость скорости реакции от различных факторов, а также механизм реакции.
Скорость реакции – число элементарных реакций между взаимодействующими частицами в единицу времени. (Vх.р),измеряется изменением концентрации какого-либо реагента или продукта в единицу времени.
Под механизмом реакции в кинетике понимают путь реакции, т.е через какие стадии протекает процесс.
Простые (элементарные) реакции - реакции, протекающие в одну стадию и описываемые уравнением скорости реакции или кинетическим уравнением.
Сложные реакции - реакции, протекающие через несколько последовательных или параллельных стадий. В этом случае кинетическое уравнение описывает самую медленную (лимитирующую) стадию.
На скорость реакции влияют многие факторы: концентрация реагентов, температура, давление, катализаторы, внешние воздействия, например излучения и др.
Первичным солевым эффектом называется изменение скорости реакции при измёнении ионной силы раствора. При этом скорости реакции меняется не за счет изменения концентрации ионов, участвующих в реакции, а за счёт изменения их коэффициентов активности.
Первичный солевой эффект в каталитических реакциях проявляется в зависимости скорости реакции от концентрации соли в том случае, когда реакция не сопровождается равновесиями, которые могут быть смещены изменением среды. Такое действие, может быть значительным в тех случаях, когда оба вступающие в реакцию вещества являются ионами. Первичный солевой эффект меньше при кислотно-основномкатализе, где одна из реагирующих молекул не заряжена.
Вторичный солевой эффект проявляется во всех случаях, когда в реакциях участвуют слабые электролиты. Вторичными солевым эффектом называется изменение скорости реакции за счет изменения концентрации ионов, участвующих в реакции при изменении степени диссоциации под влиянием солей. В случае кислотно-основных каталитических реакций вторичный солевой эффект наблюдается во всех случаях, когда катализатором выступает слабая кислота (например, СН3СООН), т.е. вторичный солевой эффект проявляется везде, где приходится учитывать концентрацию ионов слабых электролитов.