Определение катализа. Общие принципы катализа. Классификация каталитических процессов.
Катализом называютизменение скорости химических реакций в присутствии веществ, которые сами после реакции остаются химически неизмененными. Обычно катализаторами называют только ускорители реакций, а ингибиторами - замедлители.
Виды катализа
§ Гомогенном катализе реагирующие вещества и катализатор образуют однофазную систему - газовую или жидкую,между катализатором и реагирующими веществами отсутствует поверхность раздела Например, каталитическое разложение пероксида водорода в присутствии раствора солей(жидкая фаза). Для гомогенного катализа установлено, что скорость химической реакции пропорциональна концентрации катализатора.
§ Гетерогенный катализ важнейшая область катализа, имеющая широкое практическое приложение. Достаточно в этом плане отметить такие важные процессы как синтез аммиака
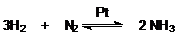
синтез метанола
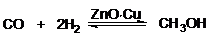
процессы дегидрирования

и другие.
Преимущества гетерогенного катализа:
-малом расходе катализатора на единицу количества продукта,
-снижении или полном устранении токсичных сточных вод и расходов дополнительных реагентов на промывку реакционной массы.
(Это обусловлено тем, что катализатор и реакционная масса находятся в разных фазах.)
По способу осуществления гетерогенно-каталитические процессы делятся на процессы со стационарным (неподвижным) катализатором, где он используется в виде достаточно крупных гранул (0,3 – 1 см) и на процессы с подвижным катализатором (плавающим, диспергированным или псевдоожиженным). В последнем случае катализатор применяют только в диспергированном виде, когда он способен перемешиваться под влиянием потока реакционной массы.
Каталитические процессы осуществляются в газовой или жидкой фазе.
Действие положительных катализаторов сводится к уменьшению энергии активации реакции, другими словами, - к снижению высоты энергетического барьера. При этом образуется активированный комплекс с более низким уровнем энергии и скорость реакции сильно возрастает.
Механизм действия катализаторов обычно объясняют образованием промежуточных соединений с одним из реагирующих веществ. Так, если медленно протекающую реакцию А + В = АВ вести в присутствии катализатора К, то катализатор вступает в химическое взаимодействие с одним из исходных веществ, образуя непрочное промежуточное соединение: А + К = АК
Реакция протекает быстро, так как энергия активации этого процесса мала. Затем промежуточное соединение АК взаимодействует с другим исходным веществом,при этом катализатор высвобождается: АК + В = АВ + К
Энергия активации этого процесса также мала, а потомуреакция протекает с достаточной скоростью Если теперь оба процесса, протекающие одновременно,суммировать,то получим окончательное уравнение быстро протекающей реакции: А + В = АВ
Активность и селективность катализатора. Требования к катализаторам.