Окислительно-восстановительные реакции
Химические реакции можно классифицировать по числу и составу участвующих веществ: например, выделяют реакции соединения, разложения, замещения и обмена. Кроме того, реакции могут протекать как без изменения степени окисления, так и с изменением степени окисления реагирующих веществ. Последние относятся к окислительно-восстановительным реакциям.
Окислительно-восстановительными являются такие процессы, в которых атомы, входящие в состав реагирующих веществ, изменяют свои степени окисления.
Классификация окислительно –восстановительных реакций
1. Реакции межмолекулярного окисления-восстановления.
Большинство привычных нам реакций именно такие.
Реакции межмолекулярного окисления-восстановления – это реакции, в которых окислитель входит в состав одного вещества, а восстановитель – в состав другого вещества.
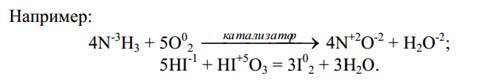
В некоторых реакциях степень окисления увеличивается (или умень-
шается) у нескольких элементов. Например:
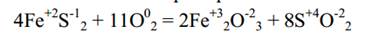
В этом процессе увеличиваются степени окисления как атомов железа,
так и атомов серы. Уменьшается степень окисления атомов кислорода.
2. Реакции внутримолекулярного окисления-восстановления.
Реакции внутримолекулярного окисления-восстановления – это реакции, в которых окислитель и восстановитель являются разными атомами, но входят в состав одного вещества.
Например:
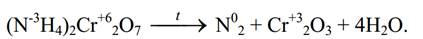
В этой реакции азот в степени окисления -3 является восстановителем,
а хром в степени окисления +6 – окислителем.
Во внутримолекулярных реакциях окисления-восстановления также
может быть несколько окислителей или несколько восстановителей, напри-
мер:
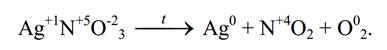
В этой реакции 2 элемента – серебро и азот – понижают свою степень
|
|
окисления, т.е. являются окислителями. Восстановитель – кислород в степе-
ни окисления -2.
3. Реакции диспропорционирования (самоокисления-самовосстанов-
ления).
Реакции диспропорционирования – это реакции, в которых окислителем и восстановителем является элемент в промежуточной степени окисления, атомы которого входят в состав одного вещества.
Например:
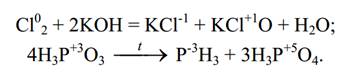
Здесь часть атомов хлора, принимая электроны, переходит в Cl-1, а дру-
гая часть атомов хлора, отдавая электроны, переходит в Cl+1. Т.е. хлор и
окисляется, и восстанавливается. То же самое можно сказать о фосфоре во
второй реакции: атомы фосфора в степени окисления +3 принимают по 6
электронов, переходя в Р-3, а другие атомы Р+3 отдают по 2 электрона, пере-
ходя в Р+5.
По аналогии с диспропорционированием выделяют реакции сопропор-
ционирования – «диспропорционирование наоборот». Примером такой ре-
акции может являться взаимодействие HI и HIO3, приведенное в пункте 1,
или разложение нитрита аммония:
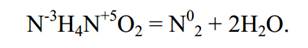
Отсюда видно, что реакции сопропорционирования могут быть как
межмолекулярными, так и внутримолекулярными.
Реакции сопропорционирования – это реакции, в которых окислителем
и восстановителем являются атомы одного и того же элемента в разных
степенях окисления, а в продукте реакции атомы этого элемента приобре-
тают промежуточную степень окисления.