Подвижность ионов.
Сила тока, проходящего через раствор, зависит от количества ионов обоих знаков перемещающихся в противоположных направлениях. Через поперечное сечение S между электродами в 1 сек пройдут все катионы и анионы, содержащие в объеме
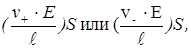
где  - абсолютные скорости движения катионов и анионов при падении потенциала в 1 В на 1 см.
- абсолютные скорости движения катионов и анионов при падении потенциала в 1 В на 1 см.
Е – разность потенциалов между электродами.
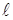 – расстояние между ними.
– расстояние между ними.
Сила тока, т.е. количество электричества в Кулонах, перенесенное ионами в 1с, равна:
 ;
;
где F – число Фарадея, равное 96500 кулонов. Согласно закона Ома
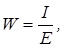 отсюда электропроводность равна
отсюда электропроводность равна
 ;
;
Если S=1 см2 а 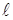 =1 см, то W представляет собой удельную электропроводность
=1 см, то W представляет собой удельную электропроводность
ℋ=  .
.
Поскольку l=ℋ 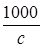 , то l=
, то l=  .
.
Абсолютные скорости ионов скорости ионов очень малы, поэтому пользуясь величинами в F раз большими, называемыми подвижностями ионов. Подвижность ионов представляет собой эквивалентные электропроводности ионов, которые обозначаются l_ и l+.
Отсюда: l_ = Fv-
l+ = Fv+
ℋ= 
l=a(l+ +l_).
При бесконечно большом разведении a=1 и эквивалентная электропроводность стремиться к наибольшему значению  . В этом случае
. В этом случае
 .
.
Подвижности ионов имеют большое значение для кондуктометрических определений, так как на основании этих величин изменяющихся в связи с изменением состава ионов можно предвидеть характер изменения электропроводности раствора в процессе титрования.
Кондуктометрическое титрование.
Большинство кондуктометрических титрований основано на следующей общей реакции, протекающей в растворе:
А+ + В- + С+ + Д- ®АД + В- + С+,
где АД может быть нерастворимым или малодиссоциированным соединением. Следовательно, в процессе титрования происходит замещение ионов А+ ионами С+ и в зависимости от того, выше или ниже подвижность ионов С+ по сравнению с ионами А+, происходит или понижение или повышение электропроводности раствора в начале титрования до точки эквивалентности.
3.1.4. Титрование кислот и оснований.
Форма титрационной кривой и угол между её ветвями зависит не только от подвижности ионов, находящихся в титруемом растворе, но и от степени диссоциации кислоты и основания, находящихся в растворе.
При кислотно-основном титровании образуется мало диссоциированная вода и сильно диссоциированная соль:
Н+ + А- + Ме+ + ОН- ®Н2О + Ме+ + А-
При этом ионы водорода и гидроксила, обладающие большой подвижностью, замещаются в растворе на менее подвижные ионы соли.
При титровании сильной кислоты сильным основанием (так же, как и при титровании сильного основания сильной кислотой), кривая кондуктометрического титрования состоит из двух прямолинейных ветвей АС и СВ.

Рис. 3.1.1. Кривая кондуктометрического титрования сильной кислоты сильным основанием.

Рис. 3.1.2. Кривая кондуктометрического титрования слабой кислоты сильным основанием.
На схеме ход кривой искажается гидролизом соли, образующейся в процессе титрования.
Образование соли уменьшает диссоциацию слабой кислоты, вследствие чего электропроводность раствора падает с накоплением соли в растворе в результате её гидролиза, например,

Малоподвижный ион  заменяется сильно подвижным ионом
заменяется сильно подвижным ионом  и вблизи точки эквивалентности электропроводность раствора несколько возрастает.
и вблизи точки эквивалентности электропроводность раствора несколько возрастает.
Эти противоположные эффекты дают кривые с минимумом, положение которых зависит как от концентрации, так и от силы слабой кислоты.
При титровании слабой кислоты слабым основанием (или слабого основания сильной кислотой) электропроводность вначале возрастает, а после прибавления избытка реактива остается постоянной, так как слабое основание мало изменяет общую электропроводность раствора.


 т.э. V, мл
т.э. V, мл
Рис. 3.1.3. Кривая кондуктометрического титрования слабой кислоты слабым основанием.
Гидролиз соли искажает кривую титрования и излома на кривой титрования не будет. В этом случае точку эквивалентности находят как пересечение прямолинейных участков кривой титрования.
3.1.5. Титрование с использованием реакции осаждения.
В качестве примера можно привести реакции:
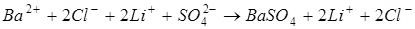
 .
.
Возможность использования различных реакций осаждения и точность определения точки эквивалентности зависит от следующих условий:
а) от величины угла излома кривой титрования;
б) от растворимости осадка;
в) от постоянства состава осадка, его чистоты и скорости осаждения.
Растворимость осадка вызывает увеличение электропроводности раствора и практически проявляется в закруглении титрационной кривой вблизи точки эквивалентности. В разведенных растворах влияние растворимости осадка очень заметно. Для уменьшения растворимости рекомендуется добавление в раствор этилового спирта и понижение температуры.
Образующиеся в процессе титрования осадки должны иметь определенный состав. Поэтому при титровании не может использоваться любая реакция осаждения. Например, при титровании щелочами катионов тяжелых металлов могут образовываться основные соли, осадки которых не имеют определенного состава. Осадки также могут загрязняться вследствие соосаждения. Более чистые осадки получаются при титровании разбавленных растворов, при медленном добавлении титранта небольшими порциями и тщательном перемешивании.
3 .1.6. Титрование с использованием ред-окс-реакций.
Применение окислительно-восстановительных (ред-окс) реакций возможно только в том случае, когда реакции протекают в умеренно кислых или щелочных растворах с участием ионов Н+ и ОН-. В сильно кислых или щелочных средах определение затруднено вследствие высокой электропроводности системы, которая маскирует изменение электропроводности при протекании ред-окс-реакции.
В качестве примера можно рассмотреть реакцию

 |
Рис. 3.1.4. Кривая кондуктометрического титрования с использованием ред-окс реакций.
Для смещения реакции вправо (связывание Н+) в раствор добавляется гидро-
карбонат. В результате окисления  в растворе накапливаются ионы I-, имеющие сравнительно высокую подвижность. Ионы Н+, образующиеся при реакции, взаимодействуют с малоподвижными ионами
в растворе накапливаются ионы I-, имеющие сравнительно высокую подвижность. Ионы Н+, образующиеся при реакции, взаимодействуют с малоподвижными ионами  с образованием
с образованием  . В результате увеличивается концентрация более подвижных ионов, что приводит к увеличению электропроводности.
. В результате увеличивается концентрация более подвижных ионов, что приводит к увеличению электропроводности.
3.1.7. Титрование с использованием реакций комплексообразования.
На основе реакции комплексообразования чаще всего используется в качестве титранта ЭДТА (двунатриевая соль этилендиаминтетрауксусной кислоты). Этим методом можно производить определение следующих ионов: Со2+, Ni2+, Сu2+, Zn2+, Cd2+, Рв2+, Fе3+, Fе2+, А13+, Мп2+, Са2+, Мg2+, Sr2+, Ва2+, ионов редкоземельных элементов, тория и урана.
При реакции катионов металла с ЭДТА в водных растворах наблюдается увеличение концентрации водородных ионов. Это приводит к увеличению электропроводности раствора до прохождения точки эквивалентности. При избытке титранта, вследствие слабо выраженных кислотных свойств у ЭТДА, ионы водорода взаимодействуют с избыточными ионами. Это приводит к снижению электропроводности.

Рис. 3.1.5. Кривая кондуктометрического титрования с использованием реакций комплексообразования.