Цель работы
Определить теплоту реакции нейтрализации сильной кислоты сильным основанием калориметрическим способом
| Наименование | Ед. изм | Кол-во |
| Оборудование | ||
| Учебно-лабораторный модуль «ТЕРМОДИНАМИКА» | шт. | |
| Сетевой кабель | шт. | |
| Платиновый термометр сопротивления | шт. | |
| Соединительный кабель для датчика | шт. | |
| Магнитная мешалка | шт. | |
| Калориметр | шт. | |
| Реактивы | ||
| Водный раствор NaOH, 0. 15 моль/л | мл | |
| Водный раствор HCl, 5 моль/л | мл | |
| Посуда | ||
| Стакан на 100 мл | шт. | |
| Пипетка мерная 5 мл, | шт. | |
| Груша | шт. | |
| Промывалка с дистиллированной водой | шт. | |
| Воронка лабораторная В- 56-80 | шт. |
ПОРЯДОК ПРОВЕДЕНИЯ РАБОТЫ
Опыт №1. Определение постоянной калориметра
Постоянную калориметра берут из лабораторной работы №1 или определяют заново по методике из вышеуказанной работы.
Опыт №2. Определение теплоты нейтрализации и разведения
Выливают из стакана раствор, ополаскивают дистиллированной водой, наливают в него 100 мл раствора щелочи с концентрацией 0,15 моль/л и устанавливают в калориметр. Производят настройку режима записи данных аналогично опыту №1. Затем проводят нейтрализацию щелочи 2 мл 5 моль/л кислотой. Далее графически определяют изменение температуры и рассчитывают сумму теплот разведения и нейтрализации.
Опыт №3. Определение теплоты разведения
Снова выливают из стакана раствор, ополаскивают дистиллированной водой, наливают в него 100 мл дистиллированной воды и устанавливают в калориметр. Производят настройку режима записи данных аналогично опыту №1. Затем в стакан добавляют 3 мл 5 моль/л кислоты. Далее графически определяют изменение температуры и рассчитывают теплоту разведения.
Пример оформления работы
1. Рассчитаем массу навески для приготовления 600 мл водного раствора NaOH, 0,15 моль/л.
Так как ближайшая мерная посуда для приготовления такого количества раствора является мерная колба на 1 л, то расчет будем производить на объем 1 л.
Рассчитаем массу навески
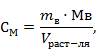
𝑚в=  ·Мв·
·Мв·  (2)
(2)
mв– масса навески, г,
CМ - молярная концентрация, моль/л,
Мв – молярная масса вещества, г,
Vр – объем растворителя, л
𝑚NaOH =0,15·40·1=6 г
2. Рассчитаем объем аликвоты кислоты для приготовления 15 мл водного раствора рHCl, 5 моль/л.
3.
Для удобства работы приготовим 100 мл, воспользуемся формулой 2.
𝑚HCl=5·36,5·0,1=18,25 г
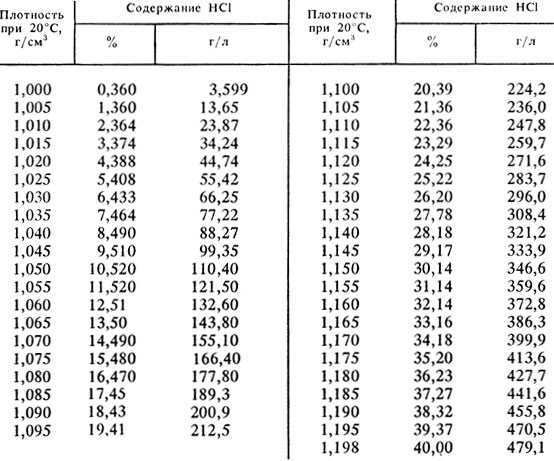
Так как соляная кислота является раствором HCl в воде, то воспользуемся таблицей зависимости плотности кислоты от содержания HCl. Плотность кислоты указана на упаковке или может быть измерена экспериментально. Возьмем для расчета При плотности соляной кислоты 1,18 г/см3, содержание HCl 427,7 г/л, значит объем кислоты, которую надо отобрать из банки для приготовления раствора заданной концентрации
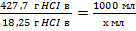 ,
,
Х=18,25*1000/427,7=42,7 мл.
Для приготовления 100 мл рHCl, 5 моль/л нужно взять 42,7 мл кислоты плотностью 1,18 г/см3, поместить в мерную колбу на 100 мл и довести до метки водой.
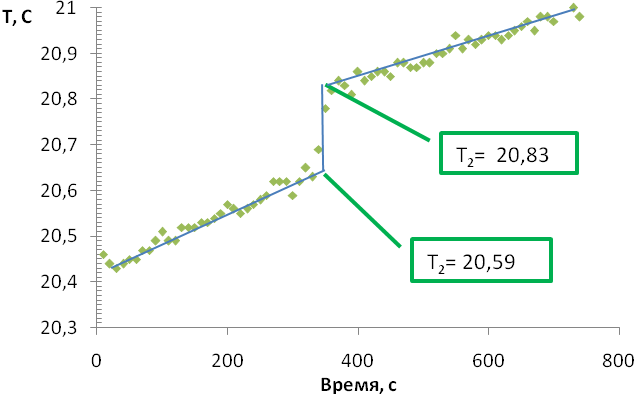
4. После сборки установки выставляем 600 измерений каждую секунду, скорость магнитной мешалки 5, помещаем в термостат раствор щелочи 100 мл 0,15 М и первые 300 измерений записываем начальный ход термограммы, далее вносим с помощью мерной пипетки 2 мл кислоты и записываем еще 300 измерений. Пример полученного графика показан на рисунке 1.
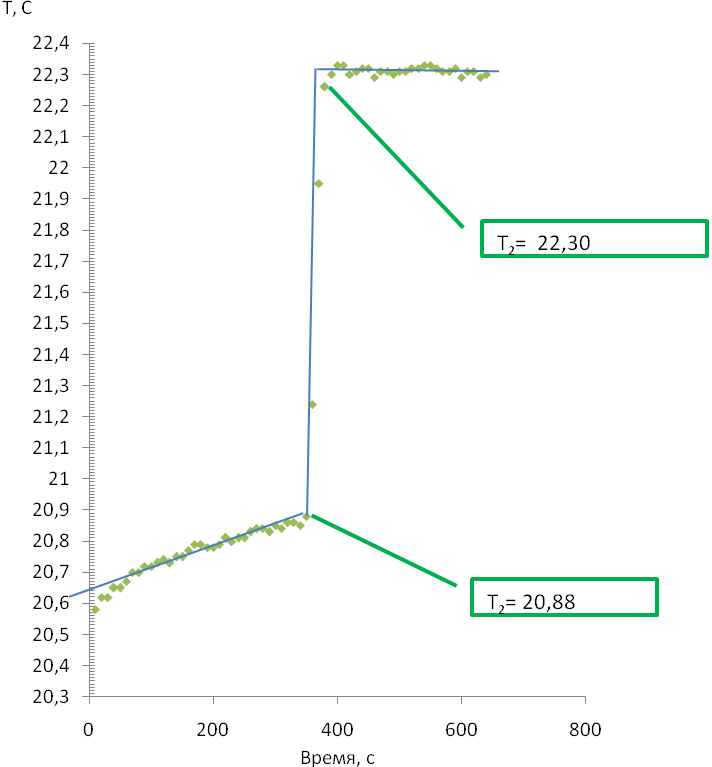
|
| Рисунок 1 – Термограмма разбавления и нейтрализации |
5. Аналогично п.3 запишем термограмму разбавления 3 мл 5 М раствора HCI. Полученная термограмма представлена на рисунке 2.
|
| Рисунок 2 – Термограмма разбавления |
6. Произведем расчет теплового эффекта реакции.
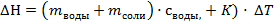
ΔH — тепловой эффект реакции, Дж.
К — постоянная калориметра,;
ΔT — действительное изменение температуры процесса растворения
mNaOH — масса щелочи (сравнительно равна объему), г;
mHC— масса кислоты (сравнительно равна объему), г;
c — теплоемкость раствора (теплоемкости разбавленных растворов неорганических солей в воде практически одинаковы и незначительно отличаются от теплоемкости воды: cp = 4,18 Дж/(г·К)).
Так как К и С во всех опытах одинаковы, то запишем их отдельно
К=30 (см. лабораторную работу №1),
С=4,18 Дж/(г•К).
Приведем полученный тепловой эффект к молю вещества в недстатке, в данном случае кислоте
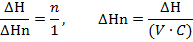
| № опыта | mNaOH,г | mHCI,г | СNaOH, М | СHCI, М | dT | ΔH, Дж | ΔHn, кДж/моль |
| Разведение и нейтрализация | |||||||
| 0,15 | -1,37 | -625,2 | -62,5 | ||||
| 0,15 | -1,4 | -638,9 | -63,9 | ||||
| 0,15 | -1,42 | -648,0 | -64,8 | ||||
| ΔHnсред | -63,7 | ||||||
| Разведение | |||||||
| mНOH,г | mHCI,г | СHCI, М | dT | ΔH, Дж | ΔHn, кДж/моль | ||
| -0,27 | -127 | -8,44 | |||||
| -0,24 | -113 | -7,50 | |||||
| -0,25 | -117 | -7,82 | |||||
| ΔHnсред | -7,9 |
Рассчитаем теплоту нейтрализации по формуле ниже и относительную ошибку согласно формуле 1 из ЛР №1, данные сведем в таблицу.
ΔНраз+нейтр = ΔНраз + ΔНнейтр,
ΔНнейтр=ΔНраз+нейтр- ΔНраз
ΔНнейтр=-63,7-(-7,9)=55,8
При теоретической теплоте нейтрализации -55,9 кДж/моль
δ=0,18 %
Критерии оценивания лабораторной работы в зависимости от полученной относительной погрешности
| Рекомендуемая оценка, балл | |||
| Погрешность, % | <3 | 3,1-5 | >5 |