Идеальных газов
Термодинамика в первую очередь рассматривает равновесные состояния и равновесные обратимые процессы, протекающие в идеализированных системах с бесконечно малыми скоростями течения процессов. Именно такие процессы поддаются графическому изображению и полному термодинамическому анализу, если известны свойства рабочего вещества.
Основными процессами, широко применяемыми в теоретических исследованиях и в технических разработках, являются:
1) изохорный (v = const);
2) изобарный (p = const);
3) изотермический (T = const);
4) адиабатный (dq = 0);
5) политропный (обобщающий).
Если, пользуясь характеристическим уравнением состояния идеального газа, теорией теплоёмкости и первым законом термодинамики, провести исследования основных термодинамических процессов, то могут быть получены следующие зависимости и величины, характеризующие термодинамические закономерности изменения состояния газов.
1.Уравнение процесса в системе координат p – v.
2.Аналитическая взаимосвязь между основными параметрами процесса (p, v, T).
3.Теплоёмкость процесса.
4.Величина изменения внутренней энергии газа.
5.Величина изменения энтальпии.
6.Работа процесса, совершаемая рабочим телом (газом) или внешней средой.
7.Количество тепла, подведённого за время процесса к рабочему телу, или отведённого от него.
Следует отметить, что действительные процессы, протекающие в природе и в технике, сопровождаются внутренним и внешним трением газа при конечных скоростях его движения и конечной разности температур, а, следовательно, не являются обратимыми. Однако многие реальные процессы сравнительно мало отличаются от идеальных (обратимых) и в расчётах их принимают за равновесные. Для остальных же в расчётные зависимости приходится вносить соответствующие корректирующие поправки (поправочные коэффициенты) из справочной литературы.
Далее приводятся расчётные зависимости и величины для основных процессов идеальных газов, исходя из условия, что теплоёмкости газов не зависят от температуры и остаются постоянными.
Примечание. При больших изменениях температуры расчёт газовых процессов следует вести с учётом зависимости теплоёмкости от температуры, используя справочные таблицы (см. раздел 5).
Изохорный процесс
Процесс, протекающий при постоянном объёме (dv = 0, или v = const), называют изохорным.
Уравнение процесса
p = 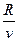 T. (7.1)
T. (7.1)
Графическую линию процесса называют изохорой.
Зависимость между параметрами описывается законом Шарля (давления пропорциональны температурам):
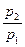 =
= 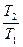 . (7.2)
. (7.2)
Теплоёмкость процесса – c  , кДж / (кг град).
, кДж / (кг град).
Изменение внутренней энергии одного кг газа
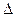 u = u
u = u  - u
- u  = c
= c 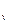 (T
(T  - T
- T  ), кДж / кг. (7.3)
), кДж / кг. (7.3)
Внешняя работа процесса при v = const, когда dv = 0,
l = 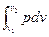 = 0. (7.4)
= 0. (7.4)
Располагаемая (полезная) внешняя работа
l 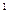 = –
= – 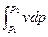 = v (p
= v (p  – p
– p  )
) 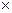 10
10 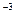 , кДж / кг, (7.5)
, кДж / кг, (7.5)
где p  и p
и p  – давление в начале и в конце процесса, Па.
– давление в начале и в конце процесса, Па.
Тепло, участвующее в процессе и идущее на изменение внутренней энергии газа,
q = 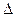 u = c
u = c 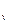 (T
(T  - T
- T  ), кДж / кг. (7.6)
), кДж / кг. (7.6)
Изобарный процесс
Процесс, протекающий при постоянном давлении (dp = 0, или p = const), называют изобарным.
Уравнение процесса
v = 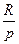 T. (7.7)
T. (7.7)
Графическую линию процесса называют изобарой.
Зависимость между параметрами описывается законом Гей-Люссака (объёмы пропорциональны температурам):
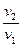 =
= 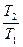 . (7.8)
. (7.8)
Теплоёмкость процесса – c 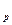 , кДж / (кг град).
, кДж / (кг град).
Изменение внутренней энергии одного кг газа определяется по формуле (7.3):
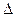 u = u
u = u  - u
- u  = c
= c 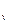 (T
(T  - T
- T  ), кДж / кг.
), кДж / кг.
Внешняя работа процесса при v = const определяется из уравнения:
l = 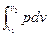 = 10
= 10 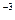
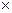 p (v
p (v  - v
- v  ) = R (T
) = R (T  - T
- T  ), кДж / кг, (7.9)
), кДж / кг, (7.9)
где p – давление в процессе, Па.
Располагаемая (полезная) внешняя работа, равная нулю:
l 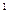 = –
= – 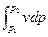 = 0. (7.10)
= 0. (7.10)
Тепло процесса, равное изменению энтальпии газа:
q = 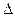 i = c
i = c 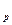 (T
(T  - T
- T  ), кДж / кг. (7.11)
), кДж / кг. (7.11)
Изотермический процесс
Процесс, протекающий при постоянной температуре (dT = 0, или T = const), называют изотермическим.
Уравнение процесса
pv = RT = const. (7.12)
Графическую линию процесса называют изотермой.
Зависимость между параметрами описывается законом Бойля-Мариотта (давления обратно пропорциональны объёмам):
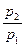 =
= 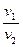 . (7.13)
. (7.13)
Теплоёмкость процесса c 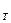 =
= 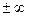 .
.
Внутренняя энергия и энтальпия газа в процессе не изменяются:
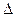 u = 0,
u = 0, 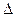 i = 0. (7.14)
i = 0. (7.14)
Внешняя работа (расширения или сжатия) процесса определяется из уравнения:
l = 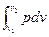 = RT
= RT 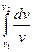 = RT ln
= RT ln 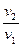 = RT ln
= RT ln 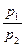 =
=
= 10 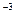
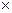 p
p  v
v  ln
ln 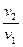 = 10
= 10 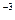
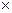 p
p  v
v  ln
ln 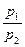 , кДж / кг, (7.15)
, кДж / кг, (7.15)
где p  и p
и p  – давление в начале и в конце процесса, Па.
– давление в начале и в конце процесса, Па.
Располагаемая работа, равная работе расширения (сжатия) процесса:
l 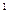 = l. (7.16)
= l. (7.16)
Тепло процесса, равное внешней работе процесса:
q = l, кДж / кг. (7.17)
Адиабатный процесс
Процесс, протекающий без теплообмена с окружающей средой (dq = 0), называют адиабатным.
Уравнение процесса:
pv 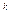 = const, (7.18)
= const, (7.18)
где k = 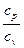
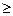 1 – показатель адиабаты.
1 – показатель адиабаты.
Графическую линию процесса называют адиабатой.
Зависимости между параметрами в адиабатном процессе:
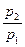 =
= 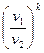 ; (7.19)
; (7.19)
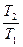 =
= 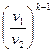 =
= 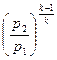 ; (7.20)
; (7.20)
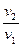 =
= 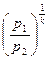 . (7.21)
. (7.21)
Теплоёмкость процесса, равная 0:
c 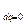 =
= 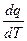 = 0. (7.22)
= 0. (7.22)
Изменение внутренней энергии одного кг газа определяется по формуле (7.3):
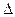 u = u
u = u  - u
- u  = c
= c 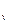 (T
(T  - T
- T  ), кДж / кг.
), кДж / кг.
В соответствии с уравнением первого закона термодинамики (q = 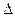 u+ l) при отсутствии теплообмена (q = 0), работа процесса равна изменению внутренней энергии, взятой с обратным знаком:
u+ l) при отсутствии теплообмена (q = 0), работа процесса равна изменению внутренней энергии, взятой с обратным знаком:
l = – 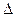 u = c
u = c 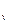 (T
(T  - T
- T  ) =
) = 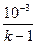 (p
(p  v
v  - p
- p  v
v  ) =
) = 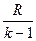 (T
(T 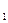 - T
- T 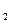 ) =
) =
= 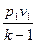
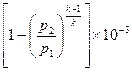 =
= 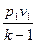
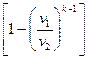
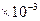 , кДж / кг, (7.23)
, кДж / кг, (7.23)
где p  и p
и p  – давление в начале и в конце процесса, Па.
– давление в начале и в конце процесса, Па.
Располагаемая работа в k раз больше работы процесса:
l 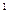 = kl, кДж / кг. (7.24)
= kl, кДж / кг. (7.24)
Политропный процесс
Любой процесс идеального газа, в котором теплоёмкость является постоянной величиной, условились называть политропным процессом. Из этого следует, что основные термодинамические процессы (изохорный, изобарный, изотермический и адиабатный), если они протекают при постоянной теплоёмкости, являются частными случаями политропного процесса.
Уравнение процесса:
pv 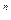 = const, (7.25)
= const, (7.25)
где n = 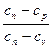 – показатель политропы, который для разных процессов может иметь
– показатель политропы, который для разных процессов может иметь
любое значение от + 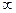 до –
до – 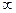 , но остаётся постоянным в данном процессе.
, но остаётся постоянным в данном процессе.
При известных начальных и конечных параметрах процесса показатель политропы рассчитывается по формуле:
n = 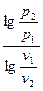 . (7.26)
. (7.26)
Графическую линию процесса называют политропой.
Зависимости между параметрами в политропном процессе:
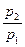 =
= 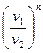 ; (7.27)
; (7.27)
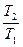 =
= 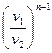 =
= 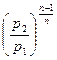 ; (7.28)
; (7.28)
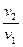 =
= 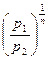 . (7.29)
. (7.29)
Теплоёмкость политропного процесса может принимать любое значение
от + 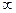 до –
до – 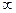 и вычисляется по формуле:
и вычисляется по формуле:
c 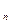 = c
= c 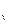
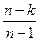 , кДж / (кг град), (7.30)
, кДж / (кг град), (7.30)
где k = 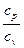
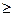 1 – показатель адиабаты.
1 – показатель адиабаты.
Изменение внутренней энергии одного кг газа определяется по формуле (7.3):
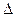 u = u
u = u  - u
- u  = c
= c 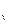 (T
(T  - T
- T  ), кДж / кг.
), кДж / кг.
Внешняя работа политропного процесса вычисляется по формуле:
l = 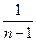
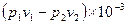 =
= 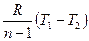 =
= 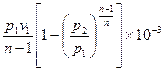 =
=
= 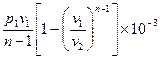 , кДж / кг, (7.31)
, кДж / кг, (7.31)
где p  и p
и p  – давление в начале и в конце процесса, Па.
– давление в начале и в конце процесса, Па.
Располагаемая работа в n раз больше работы процесса:
l 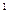 = nl, кДж / кг. (7.32)
= nl, кДж / кг. (7.32)
Тепло процесса определяется по формуле:
q = c 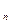 (T
(T  - T
- T  ), кДж / кг. (7.33)
), кДж / кг. (7.33)
Изображение процессов в координатах p-v
Равновесные процессы изменения состояния термодинамической системы можно изображать и исследовать графически, используя для этого двухосную систему координат, в которой осью абсцисс является удельный объём v, а осью ординат – давление p. Эта диаграмма получила название pv – диаграмма (рис.7.1).
Следует отметить, что площадь под кривой уравнения процесса на ось v представляет собой работу расширения (сжатия) l, а на ось p – располагаемую работу процесса l 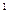 .
.
 p
p



 6 1 pv
6 1 pv 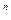 = const
= const
 |
l 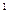 = S
= S 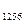

 5 2
5 2
 l = S
l = S 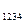
4 3 v
Рис. 7.1. pv – диаграмма.
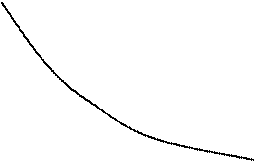
В координатах pv равновесный изохорный процесс изображается вертикальной прямой линией, изобарный – горизонтальной прямой, изотермический и адиабатный – гиперболическими линиями.
 изохора: n =
изохора: n = 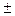
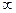 ; q > 0;
; q > 0; 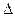 u > 0
u > 0


 p 5
p 5  2
2
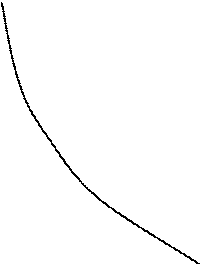 адиабата: n = k; q = 0;
адиабата: n = k; q = 0;  u > 0
u > 0

 4
4 
 q < 0
q < 0
 |
изобара: n = 0; q > 0; 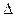 u > 0
u > 0

 3
3  3
3

 q < 0 1 изотерма: n = 0;
q < 0 1 изотерма: n = 0;
 q > 0;
q > 0; 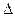 u = 0
u = 0
 |

 2
2 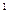
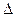 u < 0 5
u < 0 5
 |
сжатие расширение v

Рис. 7.2. pv – диаграмма политропных процессов
В связи с тем, что политропный процесс является обобщающим, а основные процессы – его частным случаем, то и уравнение политропы (pv 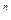 = const) является общим для всех остальных процессов, из которого можно, варьируя показателем n, получить уравнения изохоры, изобары, изотермы и адиабаты. Так, если взять изобарный процесс, то его уравнение (p = const) получают, приняв показатель n = 0; для изохорного процесса принимают n =
= const) является общим для всех остальных процессов, из которого можно, варьируя показателем n, получить уравнения изохоры, изобары, изотермы и адиабаты. Так, если взять изобарный процесс, то его уравнение (p = const) получают, приняв показатель n = 0; для изохорного процесса принимают n = 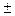
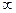 и получают зависимость p
и получают зависимость p 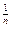 v = v = const.
v = v = const.
Уравнение политропы с показателем n = 1 является уравнением изотермического процесса:
pv = const,
а с показателем n = k является уравнением адиабатного процесса:
pv 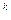 = const.
= const.
На рис. 7.2 показано расположение политропных процессов на pv – диаграмме, выходящих из одной и той же точки, в зависимости от величины показателя n.
Вопросы для самоконтроля
1. Дать определения основным термодинамическим процессам.
2. Как графически изображаются на рv -диаграмме изохора, изобара, изотерма и адиабата?
3. Написать уравнения основных процессов.
4. Написать формулы соотношений между параметрами р, v и Т для каждого процесса.
5. Написать формулы работы изменения объема газа для каждого процесса.
6. Объяснить взаимное расположение изотермы и адиабаты на рv -диаграмме, проведенных из одной точки при расширении и при сжатии газа.
7. Какой процесс называется политропным?
8. При каком условии основные процессы идеального газа будут политропными?
9. Написать уравнение политропы и указать, в каких пределах изменяется показатель политропы.
10. Каков показатель политропы для основных процессов?
Литература
1. Панкратов Г.П. Учебное пособие для неэнергетических специальностей вузов.
– 2-е изд., переработанное, доп. – М.: Высшая школа, 1986. – 248 с.
2. Теплотехника. / Под ред. Баскакова А.П. М.: Энергоатомиздат, 1991 – 223с
3. Техническая термодинамика. / Под ред. В.И. Крутова (Учебник для машиностроительных специальностей вузов) М.: 1991. – 439 с.