ХРОМ. Теоретическая часть
Хром, молибден, вольфрам составляют YIB группу периодической системы Д. И. Менделеева.
Эти элементы относятся к металлам. Их максимальная степень окисления равна шести. Химическая активность уменьшается от хрома к вольфраму. Они тугоплавки и тверды: W (т. пл. 3380°С) является самым тугоплавким из металлов.
По отношению к воздуху и воде эти металлы устойчивы вследствие образования защитных оксидных пленок. В разбавленных кислотах HCl и H2SO4 хром окисляется, превращаясь в ионы Cr2+. Mo и W устойчивы по отношению к разбавленным кислотам. Концентрированная и разбавленная HNO3 и царская водка при комнатной температуре на хром не действуют, так как пассивируют его. Для сильно пассивированного хрома стандартный потенциал становится +1,2 В, тогда как в непассивированном состоянии он равен -0,71 В. По отношению к растворам щелочей в присутствии окислителей наиболее устойчив хром, менее стоек молибден и неустойчив вольфрам. Взаимодействуя при высокой температуре с кислородом хром образует оксид Cr2O3, а молибден и вольфрам MoO3 и WO3.
При действии аммиака на соли Cr3+ образуется серо-синий осадок Cr(OH)3 по свойствам похожий на Al(OH)3, и устанавливается система равновесий.
При добавлении кислот равновесие смещается влево, а щелочей - вправо. В концентрированных щелочах гидроксид хрома (III) растворяется, образуя комплексный ион [Cr(OH)6]3-. В щелочной среде под действием окислителей соединения хрома(III) легко окисляются в хроматы, содержащие ион CrO42- желтого цвета.
При подкислении раствора, содержащего ионы CrO42-, желтая окраска переходит в оранжевую в результате образования бихромат-иона Cr2O72-. От избытка щелочи окраска раствора вновь становится желтой вследствие обратного перехода ионов Cr2O72- в ионы CrO42-. Эти переходы объясняются сдвигом равновесия.
Хроматы и бихроматы в кислой среде являются сильными окислителями. Cr6+ восстанавливается до Cr3+. При этом желтая или оранжевая окраска растворов переходит в зеленую или зеленовато-фиолетовую.
Наиболее характерная степень окисления Mo и W в соединениях +6, а для хрома характерные степени окисления +3 и +6. Трехокиси WO3 и MoO3 плохо растворяются в воде, но хорошо растворяются в щелочах. Образуются соли молибденовой и вольфрамовой кислот.
Соединения Mo и W в степени окисления +6, в отличие от соединений Cr, являются очень слабыми окислителями.
Соли Cr3+ легко гидролизуются, образуя гидроксосоли, являющиеся устойчивыми соединениями.
Хром образует комплексные соединения, многие из них являются очень прочными.
Координационное число для Cr3+ во всех комплексных соединениях равно 6. Комплексный ион [Cr(OH)6]3- также устойчив, поэтому в избытке аммиака происходит растворение осадка Cr(OH)3.
МАРГАНЕЦ. Теоретическая часть
Марганец, технеций, рений составляют УПВ группу периодической системы Д. И. Менделеева.
Марганец, технеций, рений - металлы. Наиболее устойчивы их соединения со степенью окисления +2,+4,+7. Марганец - активный металл, его стандартный электродный потенциал =-1,179 В. Поэтому он легко растворяется в разбавленных кислотах.
С повышением степени окисления уменьшается основной характер его оксидов и гидроксидов, повышаются их кислотные свойства.
При действии щелочей на соли Mn (II) образуется осадок Mn(OH)2 легко окисляющийся на воздухе в оксид - гидроксид марганца

Для соединений Mn (II) и Mn (III) характерны восстановительные свойства, а для соединений Mn (IV), Mn (VI) и Mn (VII) - окислительные. Наиболее активно окислительные свойства проявляются у Mn (VII). Все соединения, в которых марганец находится в высшей степени окисления, являются очень сильными окислителями. Наибольшей окислительной способностью обладает перманганат – ион MnO4.
При добавлении к растворам солей Mn (II) карбоната натрия гидролиз идет до конца вследствие образования нерастворимых и слабодиссоциированных веществ.
Соединения Mn (VI) - манганаты - малоустойчивы и в нейтральных и кислых растворах подвергаются диспропорционированию.
МЕДЬ. Теоретическая часть
Медь вместе с серебром и золотом составляет IB группу периодической таблицы Д. И. Менделеева.
Атомы Cu, Ag, Au во внешнем электронном слое (как и атомы щелочных металлов) имеют по одному электрону. Атомы щелочных металлов имеют в предпоследнем слое 8 электронов (у лития 2), а элементы подгруппы меди - 18 электронов, включая полностью заполненный d-подуровень. Особенностями структуры атомов объясняется резкое отличие свойств Cu, Ag, Au от свойств щелочных металлов: 18-электронный слой у них не вполне устойчив и способен к частичной отдаче электронов. В связи с этим они проявляют степень окисления от +1 до +3. Наиболее устойчивы соединения Cu2+, Ag+, Au3+.
Стандартные электродные потенциалы Cu, Ag, Au положительны, поэтому в неокисляющих кислотах они не растворяются. Не обладают амфотерностью и со щелочами не взаимодействуют. Активность этих металлов падает от меди к золоту. Медь на воздухе постепенно покрывается зеленым налетом основной соли - карбоната гидроксомеди.
В концентрированной серной кислоте медь растворяется при кипячении:

С азотной кислотой медь реагирует хорошо, восстанавливая ее до оксидов азота NO и NO2, в зависимости от концентрации кислоты и температуры.
Серебро растворяется в азотной кислоте:
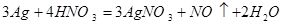
Золото растворяется в "царской водке" (смесь HNO3+HCl), образуя комплексную золотохлористоводородную кислоту:

Медь с кислородом образует оксид меди (I) Cu2O (красный) и оксид меди (II) CuO (черный). Оксид меди (I) во влажном состоянии неустойчив и происходит реакция диспропорционирования.

Оксидам меди (I) и (II) соответствуют: непрочный гидроксид CuOH (оранжевый) и гидроксид Cu(OH)2 (голубой).
Гидроксид меди (II) нерастворим в воде. Проявляет незначительную амфотерность, растворяясь, кроме кислот, в концентрированных щелочах - образуется гидроксокуприт, например Na2[Cu(OH)4]. При нагревании гидроксиды меди переходят в оксиды:

Большинство солей меди (II) при растворении в воде гидролизуются.
При совместном гидролизе солей меди (II) с карбонатом натрия образуется карбонат гидроксомеди Cu2(OH)2CO3, являющийся продуктом коррозии медных предметов на воздухе в присутствии углекислого газа.
Особенностью всех элементов IB группы является способность их ионов образовывать комплексные соединения, хорошо растворимые в воде. Наиболее характерны цианистые, роданистые, аммиачные комплексы; координационные числа 2 и 4. В водном растворе аммиака голубой осадок гидроксида меди (II) растворяется и появляется глубокая темно-синяя окраска комплексного иона [Cu(NH3)4]2+.
При переходе Cu – Ag - Au склонность к комплексообразованию усиливается.
Свойства меди и ее аналогов, включая способность образовывать комплексные соединения, широко используются при рафинировании металлов электролизом из водных растворов, гальваническом меднении и золочении, фотографии, производстве зеркал и многих других процессах.