Цинк, кадмий, ртуть составляют ПВ группу периодической системы элементов Д. И. Менделеева:
В отличие от атомов щелочноземельных металлов, на предпоследнем электронном уровне Zn, Cd, Hg не 8, а 18 электронов; d-подуровень полностью заполнен. Этим объясняется увеличение потенциала ионизации атомов, и связанное с ним ослабление восстановительной активности в сравнении с щелочноземельными металлами. Элементы ПВ группы имеют склонность к комплексообразованию. Степень окисления в соединениях единственная +2.
В обычных условиях Zn и Cd постепенно окисляются кислородом воздуха только с поверхности, покрываясь плотной пленкой оксида. При наличии в среде CO2 образуется защитная пленка Zn(OH)2CO3 на его поверхности. В растворах щелочей пленка растворяется, что позволяет Zn вступать в реакцию с водой. При прокаливании образуются оксиды: ZnO - амфотерен, CdO и HgO - обладает основными свойствами. Изменение восстановительной активности в ряду элементов Zn – Cd - Hg иллюстрируется положением этих металлов в ряду напряжений.
Цинк и кадмий растворяются в разбавленной соляной и серной кислотах (менее активно) с выделением водорода. С водой практически не реагируют, так как при погружении в воду реакция протекает на поверхности по уравнению

но тотчас же приостанавливается вследствие образования пленки гидроксида При взаимодействии цинка с кислотами-окислителями в зависимости от концентрации и температуры образуются различные продукты реакции.
Кадмий и ртуть реагируют с сильными окислителями, не менее энергично.
Ионы ртути легко восстанавливаются даже при действии малоактивных восстановителей. Ртуть растворяет многие металлы, образуя сплавы, называемые амальгамами.
В отличие от Cd и Hg металлический цинк растворяется в концентрированных растворах сильных щелочей, вытесняя водород и образуя соли – гидроксоцинкаты.
Цинк – активный металл и может выступать в реакциях с водными растворами KMnO4, K2Cr2O7 как восстановитель.
Гидроксиды Zn(OH)2, Cd(OH)2 получают взаимодействием солей со щелочами; Zn(OH)2 – амфотерен.
Cd(OH)2 - проявляет основные свойства; Hg(OH)2 - неустойчив. Практически этот гидроксид не существует, так как в момент образования он распадается.
Гидроксиды цинка, кадмия, ртути являются слабыми основаниями, поэтому соли цинка, кадмия, ртути в водных растворах подвергаются гидролизу с изменением pH среды.
При взаимодействии солей цинка с карбонатом натрия образуется карбонат цинка который в воде практически нерастворим, но гидролизуется ею с образованием основного карбоната цинка.
Благодаря своим небольшим радиусам и наличию свободных электронных уровней ионы Zn2+, Cd2+, Hg2+ являются хорошими комплексообразователями; координационные числа; для цинка 4, для кадмия 6, для ртути 2,3,4,6. Цинк образует и комплексные катионы и комплексные анионы. Комплексные анионы чаще образуются при присоединении ионом Zn2+ избыточных гидроксильных ионов с образовавшем например иона [Zn(OH)4]2-. Комплексные катионы образуются при присоединении к ионам Zn2+, Cd2+ нейтральных частиц, особенно аммиака. В результате образования таких комплексных ионов нерастворимые в воде соединения цинка и кадмия растворяются в водном растворе аммиака.
Качественной реакцией на ионы Zn2+, Cd2+, Hg2+ является реакция с H2S или ее солями, так как получаемые при этом сульфиды ZnS, CdS, HgS нерастворимы и образуют характерно окрашенные осадки.
ПРАКТИЧЕСКАЯ ЧАСТЬ
Опыт № 6. Получение и свойства гидроксида хрома (III)
К раствору соли хрома (III) добавим по каплям раствор гидроксида натрия. Полученный осадок разделим на две пробирки: а) к первой добавим избыток кислоты: б) ко второй - избыток едкого натра.

Опыт № 11 Влияние карбоната натрия на гидролиз соли хрома (III)
К раствору соли хрома (III) добавляем равный объем раствора карбоната натрия Na2CO3. Наблюдаем образование осадка Cr(OH)3.

 |  |
H2O CO2
Опыт № 13 Получение гидроксида марганца и изучите его свойств.
К раствору соли марганца (II) добавляем избыток раствора щелочи. Разделим осадок на две пробирки.
а) Осадку в первой пробирке даем постоять 5-10 мин. Осадок постепенно темнеет, так как гидроксид марганца (II) на воздухе окисляется до оксид-гидроксида марганца (II).

б) К осадку гидроксида марганца (II) во второй пробирке добавляем бромную воду.

Вывод: Mn(OH)2 легче окисляется на воздухе в присутствии бромной воды.
Опыт № 3 Получение и свойства гидроксида меди (II).
К раствору соли меди (II) добавим щелочи до получения осадка. Осадок разделим на три части:
а) к одной части добавим избыток щелочи;
б) ко второй части - кислоту;
в) третью оставим для следующего опыта.
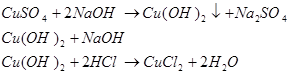
Вывод: гидроксид меди (II) проявляет незначительную амфотерность.
Опыт № 4 Непрочность гидроксида меди (II)
Осадок гидроксида меди (II), полученный в опыте 3, нагреем на небольшом пламени горелки. Осадок изменяет цвет.

Вывод: При нагревании гидроксид меди (II) переходит в оксид.
Опыт № 5 Характерная реакция на ион Cu2+
К раствору соли меди (II) добавим по каплям раствор аммиака. Затем добавим избыток аммиака. Осадок растворяется, раствор меняет цвет.

Опыт № 9 Образование карбоната гидроксомеди (малахита) при совместном гидролизе солей меди (II) и карбоната натрия.
К раствору меди добавим равный объем карбоната натрия.
