ВОПРОСЫ
Для подготовки к экзамену по дисциплине химия
ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
18. Способами передачи энергии, но с различными формами перехода, являются (работа и теплота)
19. Молекулярно-микроскопический способ передачи энергии называется (теплота)
20. Способ передачи энергии, обусловленный действием над макроскопическими телами, называется (работа)
32. Вещества (частицы), вступающие в химическую реакцию, называются (реагентами)
33. Вещества (частицы), образующиеся в результате химической реакции, называются (продуктами)
34. Вещества (частицы), вступающие в химическую реакцию и образующиеся в результате химической реакции, называются (реактантами или реагентами и продуктами соответственно)
40. Утверждение о том, что теплота, сообщаемая системе, идет на приращение внутренней энергии и на работу, совершаемую системой, является одной из формулировок (I начала термодинамики)
41. Первое начало термодинамики является, по существу, выражением закона (сохранения энергии)
42. Полной энергией системы (энергией расширенной системы) является (энтальпия)
43. Энтальпия является функцией (состояния)
44. Утверждение о том, что для двух практически важных процессов теплота процесса приобретает свойства функции состояния, является формулировкой закона (закона Гесса)
45. Математическим следствием первого начала термодинамики является закон (закон Гесса)
46. Теоретическую основу термохимии составляет закон (закон Гесса)
47. При изобарном процессе тепловой эффект реакции – это изменение _______ в ходе реакции. (энтальпии ∆H)
48. При изохорном процессе тепловой эффект реакции – это изменение _______ в ходе реакции. (внутренней энергии ∆U)
49. Давление, которое оказывал бы газ, если бы из смеси изохорно-изотермически удалили бы остальные газы, называется (парциальным)
55. Утверждение о том, что тепловой эффект реакции равен разности теплот образования продуктов и теплот образования реагентов, взятых с учетом стехиометрических коэффициентов, является формулировкой (1-го следствия закона Гесса)
56. Утверждение о том, что тепловой эффект реакции равен разности теплот сгорания реагентов и теплот сгорания продуктов, взятых с учетом стехиометрических коэффициентов, является формулировкой (1-го следствия закона Гесса)
57. В случае обратимых реакций тепловые эффекты прямой и обратной реакций (равны по абсолютной величине и противоположны по знаку)
58. На невозможность совершения работы без соответствующей затраты теплоты из окружающей среды указывает (закон сохранения энергии или I начало термодинамики)
59. На невозможность создания вечного двигателя первого рода указывает (I начало термодинамики)
60. Утверждение о том, что никакая совокупность процессов не может сводиться к превращению теплоты в работу, тогда как превращение работы в теплоту может быть единственным результатом процессов, является одной из формулировок (II начала термодинамики)
61. На невозможность создания вечного двигателя второго рода указывает (II начало термодинамики)
62. Постулат о возможном направлении и пределе самопроизвольного протекания процессов перехода энергии или вещества от одной части системы к другой при отсутствии сопротивлений процессу – это (II начало термодинамики)
63. Количественной мерой беспорядка (степени неупорядоченности) является (энтропия)
64. Не только изменение, но и абсолютное значение можно определить для (энтропии)
65. Термодинамическим параметром, который для веществ всегда больше нуля, является (энтропия)
66. Единица измерения энтропии – один (Дж/(моль*К))
67. Изменение степени неупорядоченности системы в ходе реакции (процесса) количественно характеризуется изменением (энтропии)
68. Критерием возможности и направления протекания процессов (реакций) в изолированных системах, а также критерием термодинамического равновесия является (энтропия)
69. Необходимым условием осуществления данного процесса (реакции) в изолированной системе является (возрастание энтропии) скорее всего
70. Равновесное состояние изолированной системы – это состояние, при котором (энтропия максимальна)
71. Часть теплоты (энергии) которую система может отдать окружающей среде, называется (энергия Гиббса, свободная энергия)
72. Единица измерения энергии Гиббса – один (кДж или Джоуль)
74. Критерием равновесного и самопроизвольного процессов в изобарно-изотерми-ческих условиях в неизолированной системе является (Энергия Гиббса)
75. Необходимым условием осуществления самопроизвольного процесса в изобарно-изотермических условиях в неизолированной системе является (∆G<0, G-энергия Гиббса)
80. Химические реакции, протекающие в объеме системы, называются (гомогенные)
81. Химические реакции, протекающие на границе раздела фаз, называются (гетерогенные)
86. Если экспериментально установлено, что химическая реакция, схематически представленная как
a A + b B + d D ® Продукты,
простая, то (скорость равна v = kСAaCBbCDd )
87. Если экспериментально не установлено, что химическая реакция, схематически представленная как
a A + b B + d D ® Продукты,
простая, то (скорость равна v = kСAaCBbCDd )
88. Константа скорости реакции зависит только от (температуры и природы реагента)
90. Утверждение о том, что скорость реакции в каждый момент времени пропорциональна произведению наличных, возведенных в некоторые степени, концентраций реагентов, является формулировкой (основного закона кинетики)
94. Числом частиц-реактантов, одновременно участвующих в элементарном химическом акте, определяется (молекулярность химической реакции)
98. При изменении общего давления в 3 раза скорость реакции первого порядка, в которой имеются газообразные реагенты (увеличится или уменьшится в 3 раза)
99. При изменении общего давления в 4 раза скорость реакции второго порядка, в которой имеются газообразные реагенты (увеличится или уменьшится в 16 раз)
100. При изменении общего давления в 2 раза скорость реакции третьего порядка, в которой имеются газообразные реагенты (увеличится или уменьшится в 8 раз)
101. В соответствии с правилом Вант-Гоффа увеличении температуры на 10 K вызывает увеличение скорости реакции в (2 – 4 раза)
102. Для понижения скорости реакции, температурный коэффициент скорости которой равен 3, в 27 раз температуру надо (снизить на 30 градусов)
103. Скорость реакции возросла в 16 раз при повышении температуры на 40 градусов. Температурный коэффициент скорости реакции равен (равен 2)
104. Скорость химической реакции изменяется под действием веществ, называемых (катализаторами)
105. Вещества, вызывающие отрицательный катализ, называются (ингибиторами)
106. Энергии активации реакции при каталитическом  , некаталитическом
, некаталитическом  процессах и при ингибировании
процессах и при ингибировании 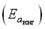 изменяются в ряду (Eaк < Ea < Ea инг)
изменяются в ряду (Eaк < Ea < Ea инг)
ХИМИЧЕСКОЕ РАВНОВЕСИЕ
107. Неизменностью состояния системы при сохранении внешних условий (внешних параметров равновесия) характеризуется (химическим равновесием, константой равновесия)
108. Реакции, протекающие в прямом и обратном направлениях, называются (обратимыми)
109. Температура, общее давление и количества веществ всех участников реакции являются (внешними параметрами равновесия)
116. Утверждение о том, что отношение произведения равновесных молярных концентраций (парциальных давлений) продуктов в степенях, равных стехиометрическим коэффициентам, к произведению равновесных молярных концентраций (парциальных давлений) реагентов в степенях, равных стехиометрическим коэффициентам, есть величина постоянная при данной температуре, является формулировкой (Закон Гультбергалл Вааге)
119. Значения констант равновесия (Kc и Kp) для всех положений одного состояния (одинаковы)?
122. Смещение химического равновесия – это (перевод равновесной химической системы из одного состояния равновесия в другое)
123. Для перевода системы из одного состояния равновесия в другое необходимо изменить (температуру)
124. Утверждение о том, что если на равновесную систему воздействовать извне изменением какого-либо внешнего параметра равновесия, то равновесие смещается в том направлении, которое способствует восстановлению первоначального положения, является формулировкой (Принципа Ле Шателье-Брауна)
РАСТВОРЫ
125. Гомогенные системы, в которых растворенное вещество диспергировано до атомного или молекулярного уровня, называются (истинными растворами)
127. Часть системы, которая может существовать вне системы, называется (составляющее вещество (Составная часть))
128. Составная часть раствора, которой больше, чем остальных, и агрегатное состояние которой совпадает с агрегатным состоянием раствора, называется (растворитель)
130. Раствор, в котором растворенного вещества мало, называется (разбавленный)
131. Раствор, в котором растворенного вещества много, называется (концентрированный)
132. Раствор, в котором данное вещество при данной температуре больше не растворяется, называется (насыщенный)
133. Раствор, в котором при данной температуре еще можно растворить некоторое количество данного вещества, называется (ненасыщенный)
137. Отношение массы i -го компонента к общей массе системы называется (массовая доля)
138. Количество растворенного вещества i -го компонента в 1 л раствора называется (концентрация)
139. Количество вещества i -го компонента, растворенного в 1 кг растворителя, называется (молярьная концентрация)
142. Процесс распада электролита на ионы называется (ионизация)
143. Для разбавленных водных растворов характер диссоциации зависит (природы диссоциирующего вещества и растворителя, температуры)
144. Электролиты, диссоциирующие необратимо, являются (сильными электролитами)
146. Доля формульных единиц, распавшихся в состоянии равновесия на ионы, называется (степень электролитической диссоциации)
148. Уравнение диссоциации
HAn( y –1)–  H+ + An y –
H+ + An y –
Является (уравнением для солей)
150. Отношение количества вещества формульных единиц, распавшихся на ионы, к общему количеству вещества растворенных формульных единиц называется (степень диссоциации)
151. Закон, характеризующий зависимость степени диссоциации от концентрации (разведения) электролита и устанавливающий связь между константой диссоциации и степенью электролитической диссоциации, называется (закон разведения Освальда)
155. Водородный показатель – это (мера активности (в очень разбавленных растворах она эквивалентна концентрации) ионов водорода в растворе, и количественно выражающая его кислотность, вычисляется как отрицательный (взятый с обратным знаком) десятичный логарифм активности водородных ионов, выраженной в молях на литр:)
156. Гидроксидный показатель – это (показатель основности раствора равная отрицательному десятичному логарифму концентрации в растворе ионов OH−)
164. Выражение [H+] = c является формулой для расчета равновесной концентрации ионов водорода в (сильных кислотах и основаниях, полностью диссоциированных на ионы, для одноосновной кислоты или основания с кислотностью 1) или просто (растворах кислот)
167. Выражение 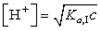 является формулой для расчета равновесной концентрации ионов водорода в (слабых кислотах)
является формулой для расчета равновесной концентрации ионов водорода в (слабых кислотах)
168. При расчете pH многоосновных слабых кислот учитывают (только 1 ступень диссоциации)
170. Для сильных электролитов для расчета равновесных концентраций ионов водорода (для кислот) и гидроксид-ионов (для оснований) нельзя пренебречь диссоциацией воды при (См<10-6 моль/л)
171. Выражение  является формулой для расчета равновесной концентрации ионов водорода в (сильных электролитах (кислотах))
является формулой для расчета равновесной концентрации ионов водорода в (сильных электролитах (кислотах))
173. Для слабых электролитов для расчета равновесных концентраций ионов водорода (для кислот) и гидроксид-ионов (для оснований) учет диссоциации воды необходимо вести при (См<10-4)
174. Выражение 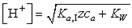 является формулой для расчета равновесной концентрации ионов водорода в (слабых кислотах)
является формулой для расчета равновесной концентрации ионов водорода в (слабых кислотах)
175. Выражение 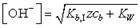 является формулой для расчета равновесной концентрации гидроксид-ионов в (слабых основаниях)
является формулой для расчета равновесной концентрации гидроксид-ионов в (слабых основаниях)
178. Утверждение о том, что если при смешении двух растворов, содержащих ионы, способные образовывать мало- или нерастворимый электролит, ионное произведение этого электролита превышает его произведение растворимости, то становится возможным выпадение осадка, а в противном случае осадок не выпадает, называется (теорией электролитической диссоциации)
179. В общем случае взаимодействие ионов, образующихся при диссоциации солей с возникновением новых ионных равновесий, называется (сольволиз)
180. Реакция обменного разложения соли водой (реакция обратная реакции нейтрализации) называется (гидролиз)
181. Образующиеся при диссоциации соли ионы могут отрывать от молекулы воды катионы водорода или гидроксид-ионы, что приводит к прекращению выполнения равновесия, характерного для чистой воды, и среда раствора становится кислой или щелочной при
182. В реакцию гидролиза вступают (только соли, образованные хотя бы одним слабым электролитом)
184. Способность данной соли подвергаться гидролизу характеризует значение (константы гидролиза соли)
185. Доля вещества, подвергшегося гидролизу, называется (степень гидролиза)
186. При гидролизе соли слабой кислоты и сильного основания имеет место (обратимый гидролиз по аниону)
188. При гидролизе соли слабого основания и слабой кислоты имеет место (как обратимый, так и необратимый гидролиз по обоим ионам)
191. При необратимом гидролизе соли слабого основания и сильной кислоты происходит образование (кислоты или слабого основания (или амфолита))
192. При необратимом гидролизе соли слабого основания и слабой кислоты происходит образование (кислоты и слабого основания (амфолита))
193. При обратимом гидролизе соли слабого основания и слабой кислоты происходит образование (кислоты и слабого основания (или амфолита))