Химия элементов
Р-элементы IVA-подгруппы
C, Si, Ge, Sn, Pb
Характеристики р-элементов IVA группы
| Элементы Характеристики | 6С | 14Si | 32Ge | 50Sn | 82Pb |
| Атомная масса | 12,01 | 28,09 | 72,59 | 118,69 | 207,19 |
| Валентные электроны | 2s22p2 | 3s23p2 | 4s24p2 | 5s25p2 | 6s26p2 |
| Металлический радиус атома, пм | − | ||||
| Ковалентный радиус атома, пм | − | ||||
| Условный радиус иона Э2+, пм | − | − | |||
| Условный радиус иона Э4+, пм | − | ||||
| Энергия ионизации | |||||
| Э0 → Э+, эВ | 11,26 | 8,15 | 7,90 | 7,34 | 7,42 |
| Э+ → Э2+, эВ | 24,38 | 16,34 | 15,93 | 14,63 | 15,03 |
| Относительная электроотрицательность | 2,5 | 1,9 | 1,8 | 1,7 | 1,6 |
Простые вещества
В виде простых веществ углерод и кремний − неметаллы, германий проявляет некоторые металлические свойства, олово и свинец − металлы.
Простые вещества элемента углерода имеют полимерное строение. Атомы углерода могут объединяться в полимерные образования с координационной (алмаз), слоистой (графит) и линейной (карбид) структурами.
Алмаз − кристаллическое бесцветное, прозрачное вещество, сильно преломляющее лучи света. Алмаз очень твёрд, тугоплавок и химически инертен. Графит − тёмно-серые кристаллы со слабым металлическим блеском. Он имеет слоистую решетку. Соседние слои атомов углерода в кристалле графита находятся на большом расстоянии друг от друга. Это приводит к малой прочности связей между слоями, поэтому графит довольно мягок, легко расслаивается, химически несколько активнее алмаза. Карбин − чёрный порошок, полупроводник. Его решётка гексагональная, построенная из прямоугольных цепочек атомов углерода. Получаемый при термическом разложении органических соединений аморфный углерод или уголь представляет собой тонкоизмельчённый графит. Технически наиболее важными сортами угля являются: кокс, древесный уголь, животный уголь, сажа. Уголь – хороший восстановитель, а активированный уголь (прокалённый древесный уголь) широко используется как адсорбент.
Для кремния характерны две модификации: алмазоподобная (кубическая) и графитоподобная (гексагональная). Последняя − неустойчива. В первой модификации кремний тугоплавок, отличается высокой твёрдостью, а при комнатной температуре кремний − полупроводник.
В ряду Ge - Sn - Pb отчётливо усиливаются металлические свойства простых веществ.
Характерные свойства и важнейшие соединения
Атомы р-элементов IVА группы имеют на внешнем энергетическом уровне 4 электрона (конфигурация валентных электронов ns2np2. Для неметаллов С, Si, Ge характерно образование четырёх ковалентных связей, что соответствует проявлению высшей степени окисления +4. Олово постепенно утрачивает способность образовывать четыре ковалентные связи, соединения становятся менее устойчивыми и появляются ионные связи при низшей степени окисления +2. Таким образом, от углерода к свинцу устойчивость соединений со степенью окисления +4 уменьшается, и для них возрастают окислительные свойства. В той же последовательности уменьшаются восстановительные свойства соединений со степенью окисления элемента +2.
| Me | С | Si | Ge | Sn | Pb |
| j°(Ме2+/Ме0), В | − | − | +0,05 | −0,14 | −0,13 |
В соответствии с потенциалами углерод, кремний и германий с разбавленными соляной и серной кислотами не взаимодействуют. Олово растворяется:
Sn + 2 НС1 = SnCl2 + Н2.
Согласно электродному потенциалу свинца, он должен реагировать с разбавленными соляной и серной кислотами. Однако на практике этого не наблюдается из-за малой растворимости образующихся солей РbСl2 и PbSO4.
В концентрированной азотной кислоте при кипячении происходит окисление С и Sn пo уравнениям:
С + 4 HNO3(конц)  СО2 + 4 NO2 + 2 Н2О;
СО2 + 4 NO2 + 2 Н2О;
Sn + 4 HNO3(конц)  H2SnО3 + 4 NO2 + Н2О.
H2SnО3 + 4 NO2 + Н2О.
Германий растворяется в азотной кислоте в присутствии плавиковой:
Ge + 4 HNO3 + 6 HF = H2GeF6 + 4 NO2 + 4 Н2О.
Свинец растворяется в разбавленной азотной кислоте, а также в уксусной и других органических кислотах:
3 Рb + 8 HNO3(разб) = 3 Pb(NO3)2 + 2 NO + 4 Н2О.
Щелочи на углерод не действуют. Кремний реагирует с ними, образуя силикаты
Si + 2 КОН + H2O = K2SiO3 + 2 Н2
Германий реагирует с щелочами в присутствии окислителей, образуя ортогерманаты:
Ge + 2 NaOH + 2 Н2О2 = Na2GeО3 + 3 Н2О.
Олово и свинец реагируют с растворами щелочей с образованием комплексных соединений:
Sn + 2 NaOH + 2 Н2О = Na2[Sn(OH)4] + Н2;
Рb + 2 NaOH + 2Н2О = Nа2[Рb(ОН)4] +Н2.
При обычной температуре вода не действует на углерод, кремний, германий и олово. Свинец (особенно в присутствии растворённого в воде СО2) подвергается окислению, а затем растворению с образованием Рb (НСО3)2.
Все пять элементов способны образовывать летучие гидриды вида ЭН4, устойчивость которых от углерода ксвинцу быстро убывает.
С кислородом углерод, кремний, германий, олово и свинец образует оксиды ЭО2 и ЭО.
Оксиды углерода и кремния со степенью окисления + 4 проявляют кислотные свойства. Им соответствуют угольная кислота (Н2СО3) и поликремниевые кислоты (xSiO2∙yH2O). Оксид германия (GeO2) – амфорное соединение; SnO2 является кислотообразующим оксидом, а РbО2 − непрочное соединение с сильными окислительными свойствами, переходящее в РbО. Оксид углерода (II) − несолеобразующий, SiO − неустойчивый, SnO и РbО − амфотерные оксиды.
Гидроксиды олова (II) и свинца (II) − малорастворимые амфотерные соединения, которые получают путём реакции обмена:
SnCl2 + 2 NaOH = Sn(OH)2 + 2 NaCl.
При сплавлении SnO и РbО с оксидами щелочных, щелочноземельных металлов и кристаллическими щелочами, образуются станниты и плюмбиты:
SnO + Na2O 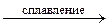 Na2SnO2,
Na2SnO2,
SnO + 2 NaOH 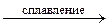 Na2SnО2 + H2O
Na2SnО2 + H2O
В водных растворах щелочей амфотерные гидроксиды Sn и Рb образуют комплексные соединения:
Sn(OH)2 + 2 NaOH = Na2[Sn(OH)4]
КРЕМНИЙ И ЕГО СОЕДИНЕНИЯ
14Si0. Электронная формула: 1s22s22p63s23p2
Для кремния характерны степени окисления + 4, −4 и в меньшей степени + 2.
Si0 + 4  → Si4−, …3s23p6
→ Si4−, …3s23p6
Si0 − 4  → Si4+, …3s03p0
→ Si4+, …3s03p0
Si0 − 4  → Si2−, …3s23p0
→ Si2−, …3s23p0
Соединения кремния со степенью окисления +2
Оксид кремния (II) можно получить нагреванием SiO2 с кремнием:
SiO2 + Si ↔ 2 SiO.
Однако, SiO очень неустойчивое соединение, которое легко разлагается на SiO2 и кремний.
Соединения кремния со степенью окисления +4
Кремний в соединениях с галогенами, кислородом, серой, азотом, углеродом и водородом имеет степень окисления + 4. Наиболее устойчивым и распространенным соединением кремния является оксид кремния (IV) SiO2 − кремнезём в виде кристаллического и аморфного Кремнезём и его производные представляют собой неорганические полимеры, построенные из тетраэдров [SiO4]4−. В центре правильного тетраэдра находится атом кремния, в вершинах -атомы кислорода. Связь Si-O − очень прочная ковалентная полярная связь. Тетраэдры могут соединяться друг с другом вершинами и по-разному располагаться в пространстве, в результате чего образуются различные кристаллические структуры кремнезёма: кварц (α, β), тридимит (α, β, γ) и кристобалит (α, β). В аморфном (стекловидном) состоянии в отличие от кристаллических модификаций SiO2 тетраэдрические структурные единицы [SiO4]4− расположены неупорядоченно. Все модификации отличаются друг от друга физическими свойствами и химической активностью.
В обычных условиях кристаллический кремнезём взаимодействует с фтором, плавиковой кислотой, очень медленно с растворами щелочей:
SiO2 + 4 HF = SiF4 + 2 Н2О;
SiO2 + 6 HF(изб.) = Н2SiF6 + 2 Н2О
При сплавлении все модификации кристаллического кремнезёма взаимодействуют с основными оксидами, щелочами, карбонатами, образуя силикаты:
SiO2 + Na2O 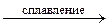 Na2SiO3;
Na2SiO3;
SiO2 + 2 NaOH 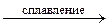 Na2SiO3 + H2O;
Na2SiO3 + H2O;
SiO2 + Na2CO3  Na2SiО3 + CO2.
Na2SiО3 + CO2.
Аморфный кремнезём более реакционноспособен, чем кристаллический. Он может вступать в химическое взаимодействие со щелочами и гашёной известью уже на холоду:
Са(ОН)2 + SiO2 = CaSiO3 + Н2О.
Кремнезём − кислотный оксид, являющийся неорганическим полимером. Ему соответствуют полимерные кремниевые кислоты состава xSiO2∙yH2O − слабые малорастворимые соединения. В свободном состоянии выделены мономолекулярные кремниевые кислоты:
− метакремниевая (кремниевая) H2SiО3 (х = у = 1),
− ортокремниевая H4SiО4 (х = 1 и у = 2) и др.
Метакремниевая кислота слабее угольной. Она диссоциирует в две ступени:
H2SiО3 ↔ H+ +  , Кд1 = 2∙10−10;
, Кд1 = 2∙10−10;
 ↔ H+ +
↔ H+ + 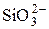 , Кд2 = 2∙10−12.
, Кд2 = 2∙10−12.
Мономолекулярные кремниевые кислоты (х = 1) неустойчивые и обычно конденсируются в полимерные формы:
2 H4SiO4 = H6Si2O7 + Н2О или
(ОН)3−Si−[OH + H]−O−Si−(OH)3 → (ОН)3−Si−O−Si−(OH)3 + H2O.
В ходе реакции поликонденсации образуется смесь различных по составу и строению моно- и поликремниевых кислот.
Кремнезём в воде практически не растворяется, поэтому кремниевые кислоты получают реакцией обмена:
Na2SiО3 + 2 НС1 = 2 NaCl + H2SiO3.
Поликремниевые кислоты легко образуют коллоидные растворы − золи. Коллоидные растворы кремниевых кислот состоят из мицелл, которые условно можно изобразить формулой:
| Гранула (коллоидная частица) | |||
| [ (H2SiO3)x | ∙ n 
| (n − m) H+ ] | ∙ m H+ |
| Ядро (1) | адсорбционный слой зарядообразующих ионов (2) | адсорбционный слой противоионов (3) | диффузионный слой (4) |
| мицелла |

|
При коагуляции, т.е. слипании коллоидных частиц золей кремниевых кислот образуются гели переменного состава общей формулы SiO2∙хH2O. Гель кремниевых кислот − микрогетерогенная система, состоящая из губчатой твердой фазы, в порах которой распределена вода. Свежеприготовленные гели могут содержать до 330 моль связанной воды на 1 моль SiO2. Богатые водой гели кремниевых кислот, называемые студнями, совершенно прозрачны, мягки, довольно эластичны. Высушенные гели кремниевых кислот − силикагели являются хорошими адсорбентами.
Соли кремниевых кислот называются силикатами. Силикаты полимолекулярных кремниевых кислот более распространены в природе. Их можно объединить формулой хR2О3∙ySiO2∙zH2O (R=Al, тогда соль – алюмосиликат).
В воде растворимы только силикаты щелочных металлов (жидкое стекло), Кислоты на силикаты действуют по-разному.
CaSiO3 + 2 НС1  H2SiO3 + CaC12
H2SiO3 + CaC12
А другие разлагаются значительно труднее или совсем не разлагаются.
Все силикатыподвергаются гидролизу, водные растворы силикатов щелочных металлов показывают сильно щелочную реакцию.
I. Na2SiO3 + H2O ↔ NaHSiO3 + NaOH;
II. NaHSiO3 + H2O ↔ H2SiО3 + NaOH.
При добавлении кислот гидролиз усиливается, и кремниевая кислота может быть выделена полностью. Тот же эффект можно получить, добавляя к растворам силикатов соли, образованные слабым основанием и сильной кислотой, например NH4Cl, NH4NO3 и др. В этом случае происходит взаимное усиление гидролиза.
Галиды кремния SiГ4 можно получить непосредственным взаимодействием простых веществ или воздействием на SiO2 соответствующей кислоты.
SiO2 + 4 HF = SiF4 + 2 H2O.
Тетрагалиды кремния легко гидролизуются практически до конца − образования Si(OH)4−H4SiO4, которая, теряя воду, превращается в H2SiО3.
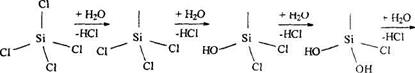
Вследствие гидролиза тетрагалиды кремния дымят во влажном воздухе.
Гомоцепи −Si−Si− характерны для гидридов кремния (силанов) гомологи-ю ряда SinH2n+2. По составу (SiH4 до n=6) и физическим свойтвам силаны сходны с соответствующими углеводородами.
Связи Si−H и Si−Si слабее аналогичных связей С−Н и С−С в углеводородах, поэтому силаны менее устойчивые и более реакционноспособны, чем соответствующие углеводороды. Большинство из них самовоспламеняются на воздухе:
SiH4 + 2 O2 = SiO2 + 2 Н2О +1288 кДж/моль.
Получают силаны только косвенным путем:
Mg2Si + 4 НС1 = SiH4 + 2 MgCl2;
Mg2Si + 4NН4Br = SiH4 + 2 MgBr2 + 4 NH3.
Соединения с двойными и тройными связями между атомами кремния (подобные алкенам и алкинам) неизвестны.
Соединения кремния с отрицательными степенями окисления
При высокой температуре (700−1200 °С) кремний и его оксид реагируют со многими металлами, образуя силициды – твердые тугоплавкие вещества.
2 Mg + Si = Mg2Si;
2 Mg + SiO2 = Mg2Si + 2 MgO.
Тип связи (в зависимости от природы металла) меняется от ионно-ковалентной до металлической, поэтому силициды имеют сложный состав, не отвечающий принятым степеням окисления:  ,
,  ,
,  .
.