Домашнее задание
Отчет по домашнему заданию должен содержать следующие выполненные пункты:
1. Расчет 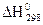 ,
, 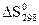 , DСР (Da, Db, Dc) химической реакции по таблицам стандартных термодинамических величин.
, DСР (Da, Db, Dc) химической реакции по таблицам стандартных термодинамических величин.
2. Результаты приближенного расчета термодинамических функций 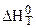 ,
, 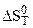 ,
, 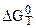 и ln KP в интервале температур Т1¸ Т2 при следующих приближениях:
и ln KP в интервале температур Т1¸ Т2 при следующих приближениях:
а) DСР=0,
б) DСР=DСР (298)=const,
Все расчеты термодинамических функций выполняются для 8¸10 температур в интервале Т1¸ Т2.
3. Результаты точного расчета указанных термодинамических величин в интервале температур Т1¸ Т2.
4. Графики температурной зависимости термодинамических функций DСР, 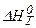 ,
, 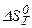 ,
, 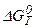 и ln KP для всех вариантов расчета. Графики одноименных величин, полученных при расчетах в разных приближениях следует изображать на одном листе, указывая какому приближению соответствует данная кривая. Всего должно быть 5 графиков по 3 кривых на каждом из них. Графики выполняются на масштабно-координатной бумаге (миллиметровке) или на компьютере.
и ln KP для всех вариантов расчета. Графики одноименных величин, полученных при расчетах в разных приближениях следует изображать на одном листе, указывая какому приближению соответствует данная кривая. Всего должно быть 5 графиков по 3 кривых на каждом из них. Графики выполняются на масштабно-координатной бумаге (миллиметровке) или на компьютере.
5. Результаты расчета равновесных составов: числа молей, мольные доли, мольные и массовые проценты, при заданных Т3 и Р для случаев, когда реагируют стехиометрические смеси
а) исходных веществ
б) всех веществ.
6. Исследование вопроса о направление реакции при температуре Т3 и Р, если в исходный момент времени взято по одному молю каждого исходного вещества и по два моля продукта реакции.
7. Термодинамический анализ выхода реакции от давления и температуры.
8. Расчет теплового эффекта достижения состояния равновесия реакционными смесями (по п. 5а и 5б).
9. Расчет условий (Р и Т) протекания реакции, при которых сумма мольных долей газообразных продуктов реакции составит 0,8, при условии, что реагирует стехиометрическая смесь исходных веществ.
· К отчету должна быть приложена распечатка файла результатов с расчетом по пунктам 3 и 5.
ТАБЛИЦА ВАРИАНТОВ ДОМАШНЕГО ЗАДАНИЯ
ПО ХИМИЧЕСКОЙ ТЕРМОДИНАМИКЕ
| № | РЕАКЦИЯ | Т1, К | Т2, К | Т3, К | Р, атм |
| H2S+2H2O=3H2+SO2 | |||||
| 2SO2+4H2=S2+4H2O | 1.5 | ||||
| 4H2O+3S2=4H2S+2SO2 | 0.5 | ||||
| Cl2+CO= COCl2 | 0.25 | ||||
| 2SO2+6CO=CS2+5CO2 | |||||
| CH4+2COS=CS2+2CO+2H2 | 1.5 | ||||
| Zn+H2O=ZnO(s)+H2 | 0.5 | ||||
| SO2Cl2+CO2= CO+SO3+Cl2 | 0.25 | ||||
| 2CO+CS2=2C(s)+CO2+S2 | |||||
| CH4+2CS2=3CS+H2S+H2 | 1.5 | ||||
| 2COS=CO2+CS2 | 0.5 | ||||
| C(s)+CO2+Cl2=COCl2+CO | 0.25 | ||||
| Zn+COS=ZnS(s)+CO | |||||
| CH4+CO2=2C(s)+2H2O | 1.5 | ||||
| CH4+COS=CS+CO+2H2 | 0.5 | ||||
| COS+3SO3+4Cl2=4SO2Cl2+CO2 | 0.25 | ||||
| COS+H2S=CS2+H2O | |||||
| Pb+H2O=PbO(s)+H2 | 1.5 | ||||
| Zn+H2S=ZnS(s)+H2 | 0.5 | ||||
| C(s)+H2S+Cl2=CS+2HCl | 0.25 | ||||
| CO+H2S=COS+H2 | |||||
| CH4+2CO=3C(s)+2H2O | 1.5 | ||||
| Pb+CO2=PbO(s)+CO | 0.5 | ||||
| CS2+2H2O+2O2=2SO3+CH4 | 0.25 | ||||
| H2S+CO2=H2O+COS | |||||
| 2C(s)+CO2+ S2=2CO+CS2 | 1.5 | ||||
| SO2+4CO=CS+3CO2 | 0.5 | ||||
| 2CS+4H2O+O2=2SO3+2CH4 | 0.25 | ||||
| COS+2CO2=SO2+3CO | |||||
| SO2+3C(s)=CS+2CO | 1.5 | ||||
| CH4+H2S=CS+3H2 | 0.5 | ||||
| 3CO+CS=SO3+4C(s) | 0.25 | ||||
| SO2+3H2=H2S+2H2O | 1.5 | ||||
| CS+2H2O=SO2+CH4 | 0.5 | ||||
| CS+4CO2=SO3+5CO | 0.25 | ||||
| CS+CO2=2C(s)+SO2 | |||||
| CoO(s)+CH4=Co(s)+CO+2H2 | 1.5 | ||||
| Zn+CO2=ZnO(s)+CO | 0.5 | ||||
| CO+O2+S2=SO3+CS | 0.25 | ||||
| CO2+H2=H2O+CO | |||||
| CS+CO=C(s)+COS | 1.5 | ||||
| 2CS=C(s)+CS2 | 0.5 | ||||
| 2SO3=2SO2+O2 | 0.25 | ||||
| CH4+2H2S=CS2+4H2 | |||||
| C(s)+2COS=CS2+2CO | 1.5 | ||||
| CH4=C(s)+2H2 | 0.5 | ||||
| H2O+Cl2+SO2 =2HCl+SO3 | 0.25 | ||||
| CH4+CS2=2CS+2H2 | |||||
| CS2+2H2=C(s)+2H2S | 1.5 | ||||
| CS+H2=C(s)+H2S | 0.5 | ||||
| 4HCl+O2=2H2O+2Cl2 | 0.25 | ||||
| 2CH4+3S2=2CS+4H2S | |||||
| 2CS=2C(s)+S2 | 1.5 | ||||
| CS2=C(s)+S2 | 0.5 | ||||
| COCl2=Cl2+CO | 0.25 | ||||
| 2CH4+S2=2CS+4H2 | |||||
| CO2+2H2=2H2O+C(s) | 1.5 | ||||
| CO+H2=H2O+C(s) | 0.5 | ||||
| Cl2+CO+SO3=SO2Cl2+CO2 | 0.25 | ||||
| CH4+S2=CS2+2H2 | |||||
| PbO(s)+H2=Pb+H2O | 1.5 | ||||
| NiO(s)+CH4=Ni(s)+CO+2H2 | 0.5 | ||||
| COCl2+CO=C(s)+CO2+Cl2 | 0.25 | ||||
| CH4+3CO2=4CO+2H2O | |||||
| PbO(s)+CO=Pb+CO2 | 1.5 | ||||
| 2C(s)+2H2O=CO2+CH4 | 0.5 | ||||
| 4SO2Cl2+CO2=COS+3SO3+4Cl2 | 0.25 | ||||
| CH4 +CO2=2CO+2H2 | |||||
| ZnS(s)+CO=Zn+COS | 1.5 | ||||
| 3C(s)+2H2O=2CO+CH4 | 0.5 | ||||
| 2SO3+CH4=CS2+2H2O+2O2 | 0.25 | ||||
| CH4+2H2O=CO2+4H2 | |||||
| C(s)+CS2=2CS | 1.5 | ||||
| ZnO(s)+H2=Zn+H2O | 0.5 | ||||
| CS+2HCl=C(s)+H2S+Cl2 | 0.25 | ||||
| C(s)+COS=CS+CO | |||||
| CO2+CS2=2COS | 1.5 | ||||
| MnO(s)+CH4=Mn(s)+2H2+CO | 0.5 | ||||
| SO3+4C(s)=CS+3CO | |||||
| CS+3CO2=4CO+SO2 | |||||
| 3CO+SO2=2CO2+COS | 1.5 | ||||
| 4H2O+S2=4H2+2SO2 | 0.5 | ||||
| 2SO3+2CH4=2CS+4H2O+O2 | 0.25 | ||||
| SO2+2C(s)=CS+CO2 | |||||
| C(s)+2COS=CS2+2CO | 1.5 | ||||
| CS2+H2O=COS+H2S | 0.5 | ||||
| SO3+CS=CO+O2+S2 | 0.25 | ||||
| C(s)+2H2S=CS2+2H2 | |||||
| ZnS(s)+H2=Zn+H2S | 1.5 | ||||
| COS+H2=CO+H2S | 0.5 | ||||
| SO3+5CO=CS+4CO2 | 0.25 | ||||
| C(s)+H2S=CS+H2 | |||||
| 2C(s)+S2=2CS | 1.5 | ||||
| H2O+COS=H2S+CO2 | 0.5 | ||||
| 2HCl+SO3=H2O+Cl2+SO2 | 0.25 | ||||
| C(s)+S2=CS2 | |||||
| C(s)+2H2O=CO2+2H2 | 1.5 | ||||
| H2O+CO=H2+CO2 | 0.5 | ||||
| 2SO2+O2=2SO3 | 0.25 | ||||
| FeO(s)+CH4=Fe(s)+CO+2H2 | |||||
| ZnO(s)+CO=Zn+CO2 | 1.5 | ||||
| CH4+H2O=CO+3H2 | 0.5 | ||||
| 2H2O+2Cl2=4HCl+O2 | 0.25 | ||||
| C(s)+H2O=CO+H2 | |||||
| C(s)+2H2=CH4 | 1.5 | ||||
| CS2 +5CO2=6CO+2SO2 | 0.5 | ||||
| 4H2S+2SO2=4H2O+3S2 | 0.25 | ||||
| CS+2CO=3C(s)+SO2 | |||||
| SO2+CH4=CS+2H2O | 1.5 | ||||
| 2CO=C(s)+CO2 |
ТЕРМОДИНАМИЧЕСКАЯ БАЗА ДАННЫХ
| Вещество | Агрегатное состояние | DHo298, Дж/моль | So298, Дж/моль×К | CP = a + b×T + c×T -2, Дж/моль×К | ||
| a | b×103 | c×10 -5 | ||||
| C | s | 5.74 | 16.86 | 4.77 | -8.54 | |
| CH4 | g | -74600 | 186.26 | 42.06 | 31.50 | -17.29 |
| CO | g | -110530 | 197.55 | 28.41 | 4.10 | -0.46 |
| CO2 | g | -393510 | 213.66 | 44.14 | 9.04 | -8.54 |
| COCl2 | g | -223000 | 289.20 | 67.16 | 12.11 | -9.03 |
| COS | g | -141700 | 231.54 | 48.12 | 8.45 | -8.20 |
| CS | g | 210.45 | 33.70 | 2.04 | -4.57 | |
| CS2 | g | 237.77 | 52.09 | 6.69 | -7.53 | |
| Cl2 | g | 223.0 | 36.69 | 1.05 | -2.52 | |
| Co | s | 30.04 | 7.69 | 30.25 | 9.06 | |
| CoO | s | -238900 | 52.93 | 48.28 | 8.54 | 1.67 |
| Fe | s | 27.15 | -16.64 | 69.15 | 21.95 | |
| FeO | s | -264850 | 60.75 | 50.80 | 8.61 | -3.31 |
| H2 | g | 130.52 | 27.28 | 3.26 | 0.50 | |
| H2O | g | -241810 | 188.72 | 30.00 | 10.71 | 0.33 |
| H2S | g | -20600 | 205.69 | 29.37 | 15.40 | 0.00 |
| HCl | g | -92300 | 186.70 | 26.53 | 4.60 | 1.09 |
| Mn | s | 32.01 | 27.41 | 10.01 | -3.79 | |
| MnO | s | -385100 | 61.50 | 46.48 | 8.12 | -3.68 |
| Ni | s | 29.87 | 34.06 | -0.92 | -7.21 | |
| NiO | s | -239740 | 37.99 | 63.17 | -6.53 | -13.55 |
| O2 | g | 205.03 | 31.46 | 3.39 | -3.77 | |
| Pb | g | 175.26 | 20.80 | 0.00 | 0.00 | |
| PbO | s | -218100 | 68.70 | 47.09 | 11.44 | -4.03 |
| S2 | g | 228.06 | 36.11 | 1.09 | -3.51 | |
| SO2 | g | -296710 | 248.11 | 49.76 | 4.71 | -10.06 |
| SO2Cl2 | g | -358700 | 311.30 | 53.72 | 79.50 | 0.00 |
| SO3 | g | -395200 | 256.23 | 57.32 | 26.86 | -13.05 |
| Zn | g | 160.90 | 20.79 | 0.00 | 0.00 | |
| ZnO | s | -348110 | 43.51 | 48.99 | 5.10 | -9.12 |
| ZnS | s | -205360 | 57.69 | 49.25 | 5.27 | -4.85 |
ПРИМЕЧАНИЕ: s – твердое вещество, g – газ.