Начало формы
1. k1 и k2 - соответственно константы скоростей прямой и обратной реакций. Скорость обратной химической реакции 2NO2 = 2NO + O2 равна:
1. [NO2]2
2. k2*[NO]*[O2]2
3. k1*[NO2]2
4. k2*([NO]2 + [O2])
5. k2*[NO]2*[O2]
6. k2*[NO]*[O2]
Конец формы
Начало формы
2. k1 и k2 - соответственно константы скоростей прямой и обратной реакций. Скорость прямой химической реакции N2 + 3H2 = 2NH3 равна:
1. [N2] + [H2]3
2. k1*[N2]*[3H2]
3. [N2]*[3H2]
4. k2*([NH3]2
5. k1*([N2] + [H2]3)
6. k2*[2NH3]
7. k1*[N2]*[H2]3
8. k1/k2
Конец формы
Начало формы
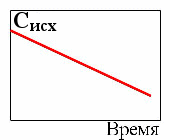
3. Зависимость концентрации исходных веществ от времени для реакции первого порядка
1. 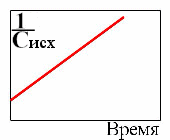 5.
5. 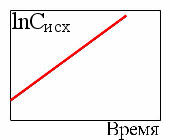
2. 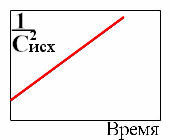 6.
6. 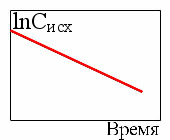
3. 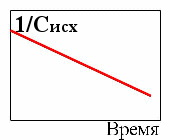 7.
7. 
4. 
Конец формы
Начало формы
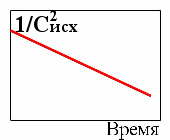
4. Зависимость концентрации исходных веществ от времени для реакции второго порядка
1.  5.
5. 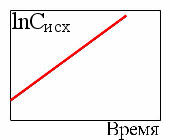
2. 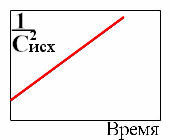 6.
6. 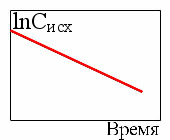
3.  7.
7. 

4. 
Конец формы
Начало формы
5. Зависимость концентрации исходных веществ от времени для реакции третьего порядка
1.  5.
5. 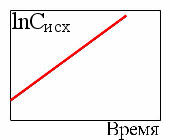
2. 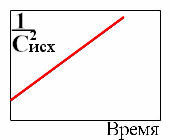 6.
6. 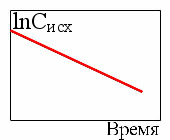
3.  7.
7. 
4. 
Конец формы
Начало формы
6. Порядок химической реакции 2H2S + SO2 = 3S + 2H2O равен
1. 2
2. 3
3. 4
4. 5
Конец формы
Начало формы
7. Порядок химической реакции 2NO2 = N2O4 равен
1. 1
2. 2
3. 3
4. 4
Конец формы
Начало формы
8. Молекулярность химической реакции 2NO2 = N2O4 равна
1. 1
2. 2
3. 3
4. 4
Конец формы
Начало формы
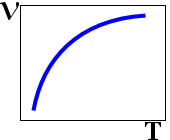
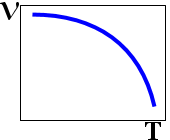
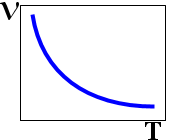
9. Зависимоть сорости реакции (V) от температуры (T)
1. 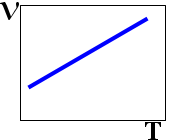 4.
4. 
2. 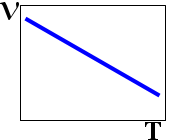 5.
5. 
3. 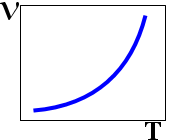 6.
6. 
Конец формы
Начало формы
10. Реакция при 60 oС протекает полностью за 270 с, а при 80 oС - за 30 с, температурный коэффициент скорости такой реакции равен
1. 2
2. 2,5
3. 3
4. 4
Конец формы
Начало формы
11. Для реакции SO2 + O -> SO3 при концентрации диоксида серы 0,25 моль/л и кислорода 0,56 моль/л скорость реакции равна 2,78*10-3 моль/(л*с). Константа скорости этой реакции составляет (л/моль*с):
1. 0,011
2. 0,02
3. 0,005
4. 0,03
5. 0,04
Конец формы
Начало формы
12. Для реакции H2 + O -> H2O при увеличении концентраций реагентов в 3 раза, скорость реакции возрастет в...
1. 3 раза
2. 6 раз
3. 9 раз
4. 12 раз
5. 27 раз
Конец формы
Начало формы
13. Разложение пероксида водорода в присутствии оксида марганца(IV) является
1. примером гетерогенного катализа
2. некаталитической реакцией
3. примером гомогенного катализа
4. цепной реакцией
Конец формы
Начало формы
14. Окисление оксида серы(IV) в оксид серы(VI) в присутствии оксидов азота является
1. примером гетерогенного катализа
2. некаталитической реакцией
3. примером гомогенного катализа
4. цепной реакцией
Конец формы
Начало формы
15. Введение в реакционную смесь катализатора
1. повышает энергию активации
2. понижает энергию активации
3. не влияет на химическое равновесие
4. увеличивает скорость только прямой реакции
5. увеличивает скорость только обратной реакции
6. увеличивает скорость как прямой, так и обратной реакции
7. смещает химическое равновесие вправо
8. не изменяет скорость реакции
9. смещает химическое равновесие влево
Конец формы
Начало формы
16. Промотор
1. смещает химическое равновесие
2. усиливает действие катализатора
3. является каталитическим ядом
4. не влияет на активность катализатора
5. ослабляет действие катализатора
Конец формы
16. Согласно правила Вант – Гоффа величина температурного коэффициента ¡ колеблется в пределах:
а) 0-14
б) 7-14
в) 2-4
17.Из ниже предложенных выберите каталитический процесс:
а) А+В+К ® С+К
б)А+В ® К
в) А+В+К ® С
18. В реакции А+3ВÛ 2С+D (все вещества газы) при повышении давления равновесия сместиться:
а) Вправо
б) Не изменится
в) Влево
19. В реакции А+ВÛС+D+DQ при повышении температуры равновесия сместиться:
а) Вправо
б) Не изменится
в) Влево
20. Закон действующих масс описывает зависимость:
а) Выхода реакции от концентрации
б) Скорости от концентрации
в) Массы от температуры
21. Выберите из перечисленных ниже мономолекулярную реакцию
а) H2 + I2 ® 2 HI
б) 2NO + O2 ® 2NO2
в) I2 ® 2I
22. Выберите из перечисленных ниже бимолекулярную реакцию:
а) H2 + I2 ® 2 HI
б) 2NO + O2 ® 2NO2
в) I2 ® 2I
23. Выберите из перечисленных ниже тримолекулярную реакцию:
а) H2 + I2 ® 2 HI
б) 2NO + O2 ® 2NO2
в) I2 ® 2I
24. Энергия активации – это энергия:
а) Переводящая частицу в возбужденное состояние;
б) Движения частицы
в) Необходимая для акта химического взаимодействия
25. Какие факторы смещают вправо равновесие реакции
HNO3 + HOH = H3O+ + NO3 – + Q
а) понижение температуры
б) повышение температуры
в) подкисление раствора
11. Какие факторы смещают влево равновесие CO (г)+2H2(г) = CH3OH (ж)- Q
а) повышение температуры
б) повышение давления
в) уменьшение температуры угарного газа
26. Во сколько раз уменьшится скорость реакции А2(г) + В2(г) = 2АВ (г), если концентрацию вещества А уменьшить в 2 раза, а концентрацию вещества В уменьшить в три раза?
а) 3
б) 5
в) 6