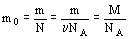Реферат
Выполнила:
Студентка 12группы
Сметанина Дарина Владимировна
Проверила:
г.Макеевка 2017
Опытное обоснование основных положений МКТ:
Молекулярно-кинетическая теория – учение о строении и свойствах вещества, использующее представление о существовании атомов и молекул как наименьших частиц химического вещества. В основе МКТ лежат три строго доказанных с помощью опытов утверждения:
· Вещество состоит из частиц – атомов и молекул, между которыми существуют промежутки;
· Эти частицы находятся в хаотическом движении, на скорость которого влияет температура;
· Частицы взаимодействуют друг с другом.
То, что вещество действительно состоит из молекул, можно доказать, определив их размеры: Капля масла расплывается по поверхности воды, образуя слой, толщина которого равна диаметру молекулы. Капля объемом 1 мм3 не может расплыться больше, чем на 0,6 м2:

Существуют также другие способы доказательства существования молекул, но перечислять их нет необходимости: современные приборы (электронный микроскоп, ионный проектор) позволяют видеть отдельные атомы и молекулы.
Силы взаимодействия молекул. а) взаимодействие имеет электромагнитный характер; б) силы короткодействующие, обнаруживаются на расстояниях, сопоставимых с размерами молекул; в) существует такое расстояние, когда силы притяжения и отталкивания равны (R0), если R>R0, тогда преобладают силы притяжения, если R<R0 – силы отталкивания.
Действие сил молекулярного притяжения обнаруживается в опыте со свинцовыми цилиндрами, слипающимися после очистки их поверхностей.
Молекулы и атомы в твердом теле совершают беспорядочные колебания относительно положений, в которых силы притяжения и отталкивания со стороны соседних атомов уравновешены. В жидкости молекулы не только колеблются около положения равновесия, но и совершают перескоки из одного положения равновесия в соседнее, эти перескоки молекул являются причиной текучести жидкости, ее способности принимать форму сосуда. В газах обычно расстояния между атомами и молекулами в среднем значительно больше размеров молекул; силы отталкивания на больших расстояниях не действуют, поэтому газы легко сжимаются; практически отсутствуют между молекулами газа и силы притяжения, поэтому газы обладают свойством неограниченно расширяться.
|
|
Масса и размер молекул. Постоянная Авогадро:
Любое вещество состоит из частиц, поэтому количество вещества принято считать пропорциональным числу частиц. Единицей количества вещества является моль. Моль равен количеству вещества системы, содержащей столько же частиц, сколько содержится атомов в 0,012 кг углерода.
Отношение числа молекул к количеству вещества называется постоянной Авогадро:

Постоянная Авогадро равна  . Она показывает, сколько атомов или молекул содержится в одном моле вещества.
. Она показывает, сколько атомов или молекул содержится в одном моле вещества.
Количество вещества можно найти как отношение числа атомов или молекул вещества к постоянной Авогадро:

Молярной массой называется величина, равная отношению массы вещества к количеству вещества:

Молярную массу можно выразить через массу молекулы:

Для определения массы молекул нужно разделить массу вещества на число молекул в нем: