Е.А.Зеляева
Основы общей химии в задачах и упражнениях
Учебно-методическое пособие
Под редакцией д.х.н. Лилеева А.С.
Москва 2010 г.
Раздел I: Основные понятия и простейшие расчеты
Все законы химии базируются на атомно-молекулярном учении, в связи с чем основополагающими понятиями в химии являются понятия атома и молекулы.
Атомом называется мельчайшая частица химического элемента, сохраняющая его химические свойства.
Атом каждого элемента состоит из ядра, масса которого складывается из определенного количества протонов и нейтронов, и вращающихся вокруг него электронов, число которых равно числу протонов, т.е. заряду ядра. Заряд ядра равен порядковому номеру элемента в Периодической системе Д.И. Менделеева и является величиной, определяющей химические свойства элемента. Например, порядковый номер цинка – 30, это означает, что ядро его атома содержит 30 протонов, заряд ядра равен +30, число электронов в атоме цинка – тридцать. Атомы, обладающие одинаковым зарядом ядра (и, следовательно, тождественными химическими свойствами), но разным числом нейтронов, называются изотопами.
Элементом называется вид атомов, характеризующихся определенной величиной положительного заряда ядра.
Все открытые на Земле элементы систематизированы в таблице Д.И. Менделеева. Они подразделяются на металлы и неметаллы. Каждый элемент имеет свое название и символ (например, Na – натрий, Р – фосфор).
Все вещества делятся на простые и сложные. Для большинства из них мельчайшей частицей является молекула, которая состоит из атомов, число которых и взаимное расположение в молекуле определяют свойства вещества.
Молекула – это наименьшая частица вещества, обладающая его химическими свойствами.
Молекулы могут состоять из атомов одного или нескольких элементов.
Сложное вещество, или соединение – это вещество, состоящее из атомов различных элементов.
Молекула вещества изображается химической формулой, состоящей из символов элементов, входящих в ее состав, с указанием числа атомов каждого элемента. Например, формула воды -  (два элемента: водород и кислород) формула соды -
(два элемента: водород и кислород) формула соды - 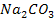 (три элемента: натрий, углерод, кислород).
(три элемента: натрий, углерод, кислород).
Простое вещество – это вещество, в состав которого входят атомы одного элемента.
Простые вещества могут состоять из атомов, молекул, а также иметь более сложную структуру.
Большинство простых веществ, независимо от их микроструктуры, принято обозначать только одним символом образующего их элемента, Э. Например, сера –  , углерод –
, углерод –  , фосфор –
, фосфор –  , медь –
, медь –  , калий –
, калий – 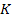 , кальций –
, кальций –  , марганец –
, марганец –  , магний –
, магний –  .
.
Некоторые простые вещества состоят из двухатомных молекул и имеют формулу  . Это: водород -
. Это: водород -  , азот -
, азот -  , кислород -
, кислород -  , фтор -
, фтор -  , хлор –
, хлор –  , бром -
, бром -  , йод -
, йод -  .
.
Элемент кислород образует еще одно простое вещество, озон, молекула которого состоит из трех атомов,  .
.
Атомы одного и того же элемента могут образовывать несколько простых веществ, различных по своим свойствам. Это явление называется аллотропией, а вещества – аллотропическими модификациями. Аллотропические модификации отличаются друг от друга либо различным числом атомов в молекуле, например, кислород О2 и озон О3, либо разной кристаллической структурой, например, углерод, алмаз и карбин, химический знак которых – С.
Понятие «простое вещество» нельзя отождествлять с понятием «химический элемент». Так, азотная кислота,  , состоит не из простых веществ водорода (
, состоит не из простых веществ водорода ( ), азота (
), азота ( ) и кислорода (
) и кислорода ( ), а из элементов водорода (
), а из элементов водорода (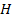 ), азота (
), азота (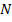 ) и кислорода (
) и кислорода ( ).
).
Химическая формула сложного вещества указывает не только на качественный, но и на количественный состав соединения. Например, формула серной кислоты -  . Это означает, что молекула этого вещества состоит из одного атома серы, двух атомов водорода и четырех атомов кислорода. Соотношение между числом атомов различных элементов в молекуле определяется валентностью этих элементов.
. Это означает, что молекула этого вещества состоит из одного атома серы, двух атомов водорода и четырех атомов кислорода. Соотношение между числом атомов различных элементов в молекуле определяется валентностью этих элементов.
Валентность элемента – это способность его атомов соединяться с другими атомами в определенных соотношениях.
Валентность – сложное понятие, его современное значение будет выяснено при изучении теории строения вещества.
Наряду с валентностью употребляется понятие степень окисления.
Степень окисления – это условный заряд атома данного элемента в соединении, вычисленный, исходя из предположения, что все атомы в молекуле ионизированы, т.е. имеют заряд.
Степень окисления может иметь положительное, отрицательное и нулевое значения, которые обычно ставятся над символом элемента сверху. Например, 
 . Степень окисления некоторых элементов в простых веществах равна нулю
. Степень окисления некоторых элементов в простых веществах равна нулю  ,
,  .
.
Степень окисления некоторых элементов в их соединениях имеет постоянное значение. К этим элементам относятся: кислород  , алюминий
, алюминий  , все элементы I группы Периодической системы Д.И. Менделеева (степень окисления
, все элементы I группы Периодической системы Д.И. Менделеева (степень окисления  ), а так же II группы (степень окисления
), а так же II группы (степень окисления  ), за исключением меди, золота и ртути, которые имеют переменную степень окисления
), за исключением меди, золота и ртути, которые имеют переменную степень окисления  (
(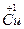 ,
,  ,
,  ,
,  ,
,  ,
,  ). Следует также запомнить водород, который имеет степень окисления, равную
). Следует также запомнить водород, который имеет степень окисления, равную  , во всех соединениях, кроме гидридов, в которых степень окисления водорода равна
, во всех соединениях, кроме гидридов, в которых степень окисления водорода равна  (
( ,
,  ), а также галогены, которые имеют степень окисления
), а также галогены, которые имеют степень окисления  , когда они входят в состав галогеноводородных кислот или их солей (
, когда они входят в состав галогеноводородных кислот или их солей ( ,
,  ,
,  ,
,  ).
).
Степень окисления большинства элементов имеет переменное значение, например,  ,
,  ,
,  ,
,  ,
,  .
.
Многообразие положительных степеней окисления проявляется у элементов 4 – 8 групп Периодической системы. При этом максимальная положительная степень окисления не может быть больше номера группы. Например, азот находится в 5 группе, его положительная степень окисления не может равняться  .
.
В неорганических соединениях степени окисления и валентности элементов численно совпадают, но обозначаются по-разному. Степень окисления записывается арабской цифрой с указанием знака ( или
или  ), а валентность обозначается соответствующей римской цифрой.
), а валентность обозначается соответствующей римской цифрой.
Так, степень окисления в  и
и  равны соответственно
равны соответственно  и
и  . В
. В  сера двухвалентна,
сера двухвалентна,  (II), а в
(II), а в  – четырехвалентна,
– четырехвалентна,  (IV).
(IV).
Алгебраическая сумма степеней окисления атомов в соединениях всегда равна нулю, а в сложном ионе – заряду иона.
В качестве примера рассмотрим серную кислоту. Элементы, составляющие молекулу серной кислоты,  , имеют следующие степени окисления: водород
, имеют следующие степени окисления: водород  , кислород
, кислород  , сера
, сера  . Суммарный отрицательный заряд равен восьми (четыре атома кислорода, каждый со степенью окисления, равной
. Суммарный отрицательный заряд равен восьми (четыре атома кислорода, каждый со степенью окисления, равной  ), суммарный положительный заряд также равен восьми (два атома водорода со степенью окисления
), суммарный положительный заряд также равен восьми (два атома водорода со степенью окисления  и один атом серы со степенью окисления
и один атом серы со степенью окисления  ).
).
Для того, чтобы определить неизвестную степень окисления элемента в соединении, надо подсчитать сумму положительного и отрицательного зарядов атома элементов с известными степенями окисления. Разность между ними даст величину искомой степени окисления.
Пример 1. Определить степень окисления марганца в марганцовой кислоте  .
.
Решение. Проставим известные степени окисления:  . Сумма всех степеней окисления должна быть равна нулю. Обозначим степень окисления марганца через
. Сумма всех степеней окисления должна быть равна нулю. Обозначим степень окисления марганца через  . Составим алгебраическое уравнение, учитывая, что в формуле марганцовой кислоты один атом водорода и четыре атома кислорода
. Составим алгебраическое уравнение, учитывая, что в формуле марганцовой кислоты один атом водорода и четыре атома кислорода

Отсюда степень окисления марганца равна  .
.
Пример 2. Определить степень окисления хрома в дихромате калия 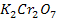 .
.
Решение. Как и в предыдущем примере, подставим известные степени окисления
( ) и составим алгебраическое уравнение. Учитывая, что в молекуле
) и составим алгебраическое уравнение. Учитывая, что в молекуле 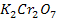 два атома хрома, суммарный заряд атомов хрома обозначим
два атома хрома, суммарный заряд атомов хрома обозначим 

Отсюда степень окисления хрома в 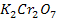 равна
равна  .
.
Упражнение. Укажите степени окисления атомов всех элементов в формулах следующих соединений:
| 1. | 
| 
| 
| 
|
| 2. | 
| 
| 
| 
|
| 3. | 
| 
| 
| 
|
| 4. | 
| 
| 
| 
|
| 5. | 
| 
| 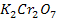
| 
|
| 6. | 
| 
| 
| 
|
| 7. | 
| 
| 
| 
|
| 8. | 
| 
| 
| 
|
| 9. | 
| 
| 
| 
|
| 10. | 
| 
| 
| 
|
Массы атомов и молекул очень малы (10-25 – 10-20г) и пользоваться ими при расчетах неудобно. Поэтому в химии введены относительные величины масс атомов и молекул, которые называются атомными или соответственно молекулярными массами. В качестве единицы измерения принята равная 1/12 массы атома изотопа углерода  .
.
Относительной массой элемента (сокращенно атомной массой) называется отношение средней массы атома при его природном изотопном составе к  массы атома углерода
массы атома углерода  .
.
Атомные массы элементов обозначаются  и определяются из таблицы Д.И. Менделеева, причем их значения принято округлять до целого числа. Исключение составляет масса элемента хлора, равная
и определяются из таблицы Д.И. Менделеева, причем их значения принято округлять до целого числа. Исключение составляет масса элемента хлора, равная  .
.
Относительной молекулярной массой (молекулярной массой) вещества называется масса молекулы, выраженная через атомные массы элементов, входящих в ее состав, с учетом их числа.
Молекулярная масса обозначается  .
.
Пример 3. Определить молекулярную массу сульфата натрия 
Решение. Из Периодической таблицы Д.И. Менделеева определяем атомные массы каждого элемента, входящего в состав молекулы  :
:  .
.
Молекулярная масса  будет равна
будет равна

Важнейшей количественной единицей в химии является величина, называемая молем.
Моль – это количество вещества, содержащее столько молекул, атомов, ионов или других структурных единиц, сколько содержится атомов в 12 г изотопа углерода 12С.
В одном моле любого вещества содержится 6,02×1023 структурных единиц. Число 6,02×1023 называется числом Авогадро.
Применяя понятие «моль», необходимо в каждом конкретном случае указывать, какие именно структурные единицы имеются в виду. Например, следует различать моль атомов Н, моль молекул Н2, моль ионов Н+. В моле атомов, молекул, ионов водорода содержится  атомов, молекул, ионов водорода соответственно.
атомов, молекул, ионов водорода соответственно.
Масса 1 моль вещества называется молярной (или мольной) массой и выражается в г/моль.
Численно масса 1 моль любых структурных единиц равна массе этой структурной единицы, выраженной в относительных единицах массы.
Следует отметить, что термин «моль молекул» не употребляется. Называя количеством индивидуального вещества, говорят: моль какого-то вещества, например, моль сульфата натрия ( ), моль кислорода (т.к. моль газа кислорода
), моль кислорода (т.к. моль газа кислорода  ), но! – моль атомов кислорода (
), но! – моль атомов кислорода ( ).
).
Каков количественный состав сложного вещества?
Состав сложного вещества определяется его формулой. Например, молекула метана  состоит из одного атома углерода и четырех атомов водорода. В десяти молекулах метана будет содержаться
состоит из одного атома углерода и четырех атомов водорода. В десяти молекулах метана будет содержаться  атомов
атомов  и
и  атомов
атомов 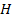 , а в
, а в  молекулах
молекулах  –
–  атомов
атомов  и
и  атомов
атомов 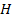 (
( - число Авогадро,
- число Авогадро,  ). Поскольку число Авогадро любых частиц составляет
). Поскольку число Авогадро любых частиц составляет  моль этих частиц, то это означает, что в
моль этих частиц, то это означает, что в  моле
моле  содержится
содержится  моль атомов углерода и
моль атомов углерода и  моль атомов водорода.
моль атомов водорода.
Таким образом, если молекула вещества состоит из определенного числа атомов (одного или разных элементов), то моль этого вещества состоит из такого же числа молей атомов тех же видов. Если молекула вещества состоит из ионов, то моль этого вещества состоит из молей этих ионов.
Масса 1 моль вещества называется молярной (или мольной) массой и выражается в  . Численно масса 1 моль любых структурных единиц равна массе этой структурной единицы, выраженной в относительных единицах массы. Молярная масса обозначается
. Численно масса 1 моль любых структурных единиц равна массе этой структурной единицы, выраженной в относительных единицах массы. Молярная масса обозначается  .
.
Пример 4: Определить молярную массу хлорида кальция,  .
.
Решение: Атомные массы кальция и хлора равны 40 и 35,5 соответственно, следовательно, молекулярная масса хлорида кальция составляет
 . Значит, молярная масса хлорида кальция
. Значит, молярная масса хлорида кальция
 .
.
Зная химическую формулу вещества и его массу, можно определить его количество, т.е. число молей этого вещества, содержащееся в данной массе. Для этого надо разделить массу соединения на его молярную массу.
Пример 5. Масса серной кислоты составляет  г. Определить количество
г. Определить количество  .
.
Решение. Сначала определим молярную массу  . Она составляет:
. Она составляет:

Число молей  будет равно
будет равно

Одним из важнейших законов химии является закон постоянства состава.
Всякое химически чистое индивидуальное вещество, независимо от способа его получения, имеет постоянный качественный и количественный состав.
Исходя из представлений атомно-молекулярной теории это означает, что каждое химически чистое вещество состоит из одинаковых молекул, в состав которых входят атомы определенных элементов. При этом соотношение между числом атомов каждого элемента и, следовательно, соотношение между их массами определяются молекулярной формулой вещества и остаются постоянными независимо от количества вещества и способа его получения.
Символ, обозначающий простое вещество, или формула сложного соединения дают целый ряд сведений об этих веществах. При этом как символ, так и формулу вещества можно интерпретировать двояко.
Пример 6: Что означает написанный отдельно символ  ?
?
1) Символ  означает, что это 1 атом элемента натрия с атомной массой
означает, что это 1 атом элемента натрия с атомной массой  .
.
Символ  означает, что это 1 моль простого вещества натрия, состоящего из
означает, что это 1 моль простого вещества натрия, состоящего из  атомов натрия, и что его молярная масса равна
атомов натрия, и что его молярная масса равна 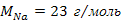 .
.
Пример 7: Что означает формула  ?
?
2) Формула  означает, что это молекула оксида натрия, которая состоит из двух атомов натрия, каждый с атомной массой
означает, что это молекула оксида натрия, которая состоит из двух атомов натрия, каждый с атомной массой  , и одного атома кислорода с атомной массой
, и одного атома кислорода с атомной массой  . Молекулярная масса
. Молекулярная масса  равна
равна
 .
.
Формула  означает, что это – 1 моль сложного вещества оксида натрия, содержащий число Авогадро
означает, что это – 1 моль сложного вещества оксида натрия, содержащий число Авогадро  молекул
молекул  . В одном моле
. В одном моле  содержатся 2 моль атомов
содержатся 2 моль атомов  и 1 моль атомов
и 1 моль атомов  . Два моля атомов
. Два моля атомов  содержат
содержат  атомов
атомов  и имеют массу
и имеют массу  Один моль атомов
Один моль атомов  содержит
содержит  атомов
атомов  и имеет массу
и имеет массу  молярная масса
молярная масса  равна
равна
 .
.
Таким образом, формула индивидуального вещества дает полную характеристику его качественного и количественного состава, что позволяет производить различные расчеты, необходимые для понимания химических процессов, а также для решения практических задач.
Пример 8: Определить массу хлора, содержащегося в 0,3 моль  .
.
Решение: В одной молекуле  содержится 1 атом хлора, следовательно, в одном моле
содержится 1 атом хлора, следовательно, в одном моле  будет содержатся один моль атомов хлора, масса которого равна 35,5 г. Составим пропорцию
будет содержатся один моль атомов хлора, масса которого равна 35,5 г. Составим пропорцию

Отсюда 
Пример 9: Какое количество азотной кислоты,  , содержит 10 г кислорода?
, содержит 10 г кислорода?
Решение: Прежде всего следует понимать, что в азотной кислоте содержится не газ кислород  , а элемент кислород (
, а элемент кислород ( ).
).
Формула азотной кислоты  , следовательно, в состав одной молекулы ее входят три атома кислорода, а в 1 моль
, следовательно, в состав одной молекулы ее входят три атома кислорода, а в 1 моль  – 3 моль атомов
– 3 моль атомов  , которые имеют массу
, которые имеют массу 
Составим пропорцию:
 .
.
Пример 10: Какая масса водорода содержит  молекул?
молекул?
Решение: Из вопроса ясно, что речь идет о газе водороде,  , моль водорода имеет массу 2 г и содержит
, моль водорода имеет массу 2 г и содержит  молекул. Составим пропорцию:
молекул. Составим пропорцию:

Отсюда 
Пример 11: Какую максимальную массу железа можно получить восстановлением 1 кг  ?
?
Решение: Молярные массы  и
и  составляет соответственно
составляет соответственно  ,
,  . В моле
. В моле  содержатся 3 моля атомов
содержатся 3 моля атомов  . Составим пропорцию:
. Составим пропорцию:

Отсюда 
Задачи I:
11. Сколько молей атомов хрома содержится в 2х молях бихромата калия  ?
?
- Определить количество карбоната кальция,
 , если в нем содержится 9 моль атомов кислорода?
, если в нем содержится 9 моль атомов кислорода? - В каком количестве сернистой кислоты,
 , будет содержаться
, будет содержаться  молекул?
молекул? - Сколько граммов калия содержится в двух молях фосфата калия,
 ?
? - Определить формулу вещества, если в моле этого вещества содержится
 атомов алюминия и
атомов алюминия и  атомов серы.
атомов серы. - Формула вещества
 . Сколько молей атомов каждого элемента содержится в 1,5 молях этого вещества?
. Сколько молей атомов каждого элемента содержится в 1,5 молях этого вещества? - Определить молярную массу вещества, если молекула этого вещества имеет массу
 граммов.
граммов. - Сколько атомов кислорода входит в состав 1 молекулы вещества, если в 1 моле этого вещества содержится
 атомов кислорода?
атомов кислорода? - Моль вещества состоит из 55 граммов марганца и
 атомов кислорода. Определить формулу вещества.
атомов кислорода. Определить формулу вещества. - Определить формулу вещества, если 1 моль его содержит 71 грамм хлора и 112 граммов кислорода.
Простые вещества и химические соединения могут находиться в трех агрегатных состояниях – твердом, жидком и газообразном. Всякое индивидуальное вещество, независимо от его агрегатного состояния, имеет постоянный состав, определяемый его химической формулой и, соответственно, молярную массу. Газы имеют еще одну важную количественную характеристику, базирующегося на законе Авогадро.
В равных объемах любых газов, взятых при одних и тех же условиях (температуре и давлении) содержится одинаковое число молекул.
В соответствии с законом Авогадро одно и то же число молекул газа занимает при одинаковых условиях один и тот же объем. С другой стороны, 1 моль любого вещества, в том числе и газообразного, содержит по определению число молекул, равное числу Авогадро,  .
.
Из уравнения состояния идеального газа  следует, что при нормальных условиях (давлении
следует, что при нормальных условиях (давлении  Па и температуре 273 К) 1 моль газа занимает объем 22,4 л, который называется мольным (молярным) объемом газа (22,4
Па и температуре 273 К) 1 моль газа занимает объем 22,4 л, который называется мольным (молярным) объемом газа (22,4  ).
).
Молярный объем  (при н.у.) относится только к газам и не может использоваться для характеристики объема жидкостей.
(при н.у.) относится только к газам и не может использоваться для характеристики объема жидкостей.
Таким образом, один моль любого индивидуального вещества имеет массу моля, в нем содержится число Авогадро ( ) частиц и, если это вещество – газ, то его объем при нормальных условиях равен 22,4 л:
) частиц и, если это вещество – газ, то его объем при нормальных условиях равен 22,4 л:

Указанные соотношения позволяют делать разнообразные расчеты и, прежде всего, определять количество вещества 𝑣.

Пример 12: Имеется 2,8 грамма газа этилена,  , определить его объем и число молекул в его составе.
, определить его объем и число молекул в его составе.
Решение:
1 способ: Определим число молей, содержащихся в 2,8 граммах этилена. Масса моля этилена  .
.

Объем газа составит  , а число молекул
, а число молекул  .
.
2 способ: Исходя из соотношения (А), составим две пропорции для определения объема  и числа молекул
и числа молекул  .
.

 .
.
Пример 13: Определить молярную массу газа, если 1,1 г его занимает объем 560 мл (н.у.).
Решение: 1 моль данного газа имеет массу моля  и объем 22,4 л, а масса этого газа, равная 1,1 г, имеет объем 560 мл=0,56 л. Составим пропорцию:
и объем 22,4 л, а масса этого газа, равная 1,1 г, имеет объем 560 мл=0,56 л. Составим пропорцию:

 .
.
Пример 14: Сколько граммов водорода содержится в 112 мл аммиака  ?
?
Решение: В 1 моле аммиака содержится 3 моль атомов водорода, т.е. 3 грамма 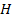 . 1 моль
. 1 моль  занимает объем 22,4 л. Составим пропорцию
занимает объем 22,4 л. Составим пропорцию

 .
.
Задачи II.
21. Сколько молей атомов азота содержится в 0,4 г нитрата аммония (NH4NO3)? Какова масса этого количества азота?
- Где содержится больше молекул, в 1 литре воды или в 1 литре (н.у.) водорода?
- Определите количество фосфора, содержащегося в 8,75 г фосфата кальция?
- В каком объеме хлора (нормальные условия) содержится столько же молекул, сколько их содержится в 49 г серной кислоты?
- Сколько моль газов содержится в смеси, состоящей из 6,72 л азота и 5,6 л оксида углерода (IV)? Объемы газов измерены при нормальных условиях.
- Масса 200 мл газа (нормальные условия) равна 0,232 г. Определите молярную массу этого газа.
- Какой объем при нормальных условиях занимают 27 1021 молекул газа?
- Где содержится больше атомов водорода: в двух литрах метана или в двух литрах водорода? Объемы газов измерены при нормальных условиях.
- Какую массу фосфата калия,
 , надо взять, чтобы внести в почву 900 г калия?
, надо взять, чтобы внести в почву 900 г калия? - Объем 1,4 г газа составляет 1,12 л (н.у.). Определить массу одной молекулы газа.
Вещества способны вступать между собой в химические реакции.
Процессы, при которых одни вещества превращаются в другие, отличающиеся от исходных своим составом и свойствами, называются химическими.
В основе химических процессов (реакций) лежит закон сохранения массы вещества.
Масса веществ, вступающих в химическую реакцию, равна массе веществ, образующихся в результате реакции.
Этот закон является частным случаем основополагающего закона природы – закона сохранения материи.
Закон сохранения массы вещества в химии выражается в составлении уравнения реакции, которое показывает, какие вещества и в каком количественном соотношении участвуют в данном процессе.
Химическое уравнение состоит из двух частей, соединенных знаком равенства. В левой части записываются формулы веществ, вступающих в реакцию, а в правой – формулы веществ, образующихся в результате реакции, согласно закону сохранения массы вещества. Число атомов каждого элемента в левой и правой частях уравнения должно быть одинаковым. Для этого в случае необходимости подбирают и расставляют перед формулами исходных и конечных веществ коэффициенты, которые называются стехиометрическими коэффициентами.
Так, уравнение взаимодействия гидроксида алюминия с серной кислотой

после подбора коэффициентов будет выглядеть следующим образом:

Коэффициенты в обеих частях уравнения химической реакции можно увеличивать или уменьшать в одинаковое число раз. Так, уравнение (1) можно записать следующим образом:

Примем n равным: а)2; б)1/2. Тогда уравнение (1) будет иметь вид


Все записанные уравнения удовлетворяют закону сохранения массы вещества.
Обычно расставляют минимальные целочисленные коэффициенты, причем коэффициент 1 опускается. В рассмотренном примере таким уравнением является уравнение (1). Уравнение реакции считается составленным только тогда, когда подобраны коэффициенты. Если при подборе коэффициентов не удается уравнять количество атомов в обеих частях уравнения, то это означает, что вещества, участвующие в реакции, написаны неправильно.
Химические уравнения можно складывать и вычитать как обычные алгебраические уравнения, если продукты одной реакции являются исходными веществами для другой. В этом случае расставляются удобные для сложения или вычитания коэффициенты.
Так, чтобы составить суммарное уравнение получения фосфорной кислоты из фосфора, кислорода и воды, надо составить два уравнения:


Чтобы исключить промежуточное вещество  , надо удвоить коэффициенты в уравнении б) и сложить оба уравнения
, надо удвоить коэффициенты в уравнении б) и сложить оба уравнения


Химическое уравнение показывает, какие вещества и в каком количественном соотношении принимают участие в данной химической реакции.
Каждая формула в уравнении химической реакции обозначает один моль соответствующего вещества. Если перед формулой стоит коэффициент  , то это означает, что в реакции участвует
, то это означает, что в реакции участвует  молей вещества. Определив молярные массы веществ, и зная их стехиометрические коэффициенты в уравнении, можно рассчитать соотношение между массами реагирующих и образующих соединений.
молей вещества. Определив молярные массы веществ, и зная их стехиометрические коэффициенты в уравнении, можно рассчитать соотношение между массами реагирующих и образующих соединений.
Если в реакции участвуют газообразные вещества, то на основании уравнения реакции можно определить не только массы реагирующих веществ, но и их объемы.
Для определения объемов газов, участвующих в химических реакциях, используется молярный объем газа, измеренного при нормальных условиях, 22,4  .
.
Расчеты по уравнениям реакции
Все расчеты по химическим уравнениям базируются на соотношении между количествами всех реагентов, которые для данной реакции всегда остаются неизменными.
По