Оксиды
Оксиды по химическим свойствам подразделяются на солеобразующие и несолеобразующие, или безразличные.
К солеобразующим оксидам относятся такие оксиды, которые способны вступать в реакции с кислотами или основаниями, а некоторые - и с кислотами и с основаниями, образуя соль. Безразличные оксиды не взаимодействуют ни с кислотами, ни с основаниями. К ним относятся  ,
,  ,
, 
Солеобразующие оксиды подразделяются на основные, кислотные и амфотерные.
Основные оксиды – это оксиды, которым соответствуют основания.
Так, например, оксиду натрия соответствует основание  , оксиду магния – основание
, оксиду магния – основание 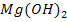 .
.
Основные оксиды образуют одно – и двухвалентные металлы, из рассматриваемых в данной работе это: оксиды щелочных металлов (все металлы IА группы), оксиды щелочноземельных металлов (кальция, стронция и бария), оксиды марганца (II), ртути (II), магния.
Кислотные оксиды – это оксиды, которым соответствуют кислоты.
Например, оксиду углерода (IV) - 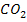 – соответствует угольная кислота
– соответствует угольная кислота  , оксиду фосфора (V) –
, оксиду фосфора (V) –  – фосфорная
– фосфорная  .
.
Кислотные оксиды образуют неметаллы ( и т.д.) и металлы с высшими валентностями, например
и т.д.) и металлы с высшими валентностями, например  ,
,  и другие.
и другие.
Кислотные оксиды иногда называют “ангидридами” соответствующих кислот, например  – фосфорный ангидрид,
– фосфорный ангидрид, 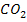 – угольный,
– угольный,  - марганцовый.
- марганцовый.
Степень окисления элемента, образующего кислотный оксид, равна степени окисления этого элемента в соответствующей кислородосодержащей кислоте: степень окисления углерода в 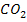 и
и  равна +4, а степень окисления фосфора в
равна +4, а степень окисления фосфора в  и
и  равна +5.
равна +5.
Упражнение
Выписать все кислородосодержащие кислоты (табл.1) и соответствующие им кислотные оксиды.
Амфотерными оксидами называются оксиды, которым соответствуют амфотерные гидроксиды, проявляющие свойства, как кислот, так и оснований.
Так, оксид цинка ZnO – амфотерный оксид, ему соответствует амфотерный гидроксид  , оксид хрома (III) -
, оксид хрома (III) -  - тоже амфотерен, ему соответствует амфотерный гидроксид
- тоже амфотерен, ему соответствует амфотерный гидроксид  . Амфотерные оксиды проявляют свойства как основных, так и кислотных оксидов.
. Амфотерные оксиды проявляют свойства как основных, так и кислотных оксидов.
Амфотерные оксиды образуют многие металлы. В пределах рассматриваемого материала необходимо запомнить следующие амфотерные оксиды:  ,
,  ,
,  ,
,  ,
,  .
.
Характер оксидов закономерно изменяется у элементов одного и того же периода. Например, свойства оксидов элементов третьего периода периодической системы Д.И. Менделеева (рассматриваются оксиды высшей валентности) с увеличением порядкового номера элемента изменяются от основных через амфотерный оксид к кислотным, т.е. ослабевают основные и усиливаются кислотные свойства оксидов.
 ,
,  ;
;  ;
;  ;
; 
Основные Амфотерный Кислотные
Элементы с переменной валентностью (степенью окисления) способны образовывать несколько оксидов. Если это оксиды неметаллов, то либо все они относятся к кислотным, либо среди них есть безразличные. Например,  ,
,  – безразличные оксиды, а
– безразличные оксиды, а  , (
, ( ),
),  - кислотные. Если оксиды образованы металлами с переменной валентностью (степенью окисления), то характер этих оксидов изменяется с изменением валентности (степени окисления) металла. Марганец образует ряд оксидов
- кислотные. Если оксиды образованы металлами с переменной валентностью (степенью окисления), то характер этих оксидов изменяется с изменением валентности (степени окисления) металла. Марганец образует ряд оксидов
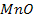 ,
,  ,
,  , (
, (  ),
), 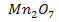
Первые два оксида являются основными оксидами, диоксид марганца  – амфотерным, последние – кислотные оксиды. Таким образом, с увеличением валентности (степени окисления) ослабевают основные и усиливаются кислотные свойства оксидов.
– амфотерным, последние – кислотные оксиды. Таким образом, с увеличением валентности (степени окисления) ослабевают основные и усиливаются кислотные свойства оксидов.
Методы получения оксидов
1. Непосредственное взаимодействие элемента с кислородом
 +
+ 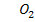 =
= 
2  +
+  =
= 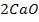
4  +
+  = 2
= 2 
2. Окисление кислородом сложных веществ
 + 2
+ 2  =
= 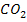 + 2
+ 2 
2  + 3
+ 3  = 2
= 2  +
+ 
3. Разложение кислот, гидроксидов и солей (карбонатов, нитратов)




Химические свойства оксидов
1. Оксиды щелочных и щелочноземельных металлов реагируют с водой с образованием щелочей
 +
+  =
= 
 +
+  =
= 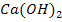
2. Большинство кислотных оксидов реагирует с водой с образованием кислот
 +
+  = 2
= 2 
3. Основные оксиды взаимодействуют с кислотами, образуя соль и воду
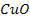 + 2
+ 2  =
=  +
+ 
4. Кислотные оксиды взаимодействуют с основаниями, образуя соль и воду
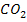 + 2
+ 2  =
= 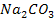 +
+ 
5. Кислотные и основные оксиды способны реагировать между собой с образованием солей
 +
+  =
= 
 +
+ 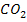 =
= 
6. Амфотерные оксиды взаимодействуют как с кислотами, так и с щелочами с образованием соли и воды. В реакциях с кислотами амфотерные оксиды (например  ,
,  ) проявляют свойства осноных оксидов. Им соответствуют основания (
) проявляют свойства осноных оксидов. Им соответствуют основания ( ,
,  )
)
 + 2
+ 2  =
= 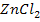 +
+ 
 + 3
+ 3  =
=  + 3
+ 3 
В реакциях сплавления с щелочами амфотерные оксиды ведут себя как кислотные оксиды (оксиду цинка соответствует цинковая кислота  , оксиду хрома – метахромистая кислота
, оксиду хрома – метахромистая кислота  )
)
 + 2
+ 2  =
=  +
+ 
 +
+ 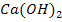 =
=  +
+ 
Контрольные задания I
1. Какие вещества называются оксидами? Приведите по два примера оксидов металов и оксидов неметаллов. Назовите их.
- Какие оксиды относятся к основным оксидам? Приведите два примера основных оксидов. Назовите их.
- Какие оксиды относятся к кислотным оксидам? Приведите два примера кислотных оксидов. Назовите их.
- Какие оксиды относятся к амфотерным оксидам? Приведите два примера амфотерных оксидов. Назовите их.
- Какие элементы образуют основные оксиды? Приведите два примера основных оксидов. Назовите их.
- Какие элементы образуют кислотные оксиды? Приведите два примера кислотных оксидов. Назовите их.
- Какие оксиды называются солеобразующими? Приведите три примера солеобразующих оксидов. Назовите их.
- Какие оксиды называются безразличными? Приведите два примера безразличных оксидов. Назовите их.
- Как изменяются свойства оксидов элементов (III) периода периодической системы элементов Д.И.Менделеева?
- Основные методы получения кислотных оксидов. Приведите два уравнения реакции.
- Основные методы получения основных оксидов. Приведите два уравнения реакции.
- Какие оксиды могут реагировать как с кислотами, так и с основаниями? Ответ пояснить уравнениями реакций.
- Какие оксиды реагируют с кислотами? Приведите два примера уравнения реакции взаимодействия таких оксидов с соляной кислотой.
- Какие оксиды реагируют с щелочами? Приведите два уравнения реакции взаимодействия таких оксидов с едким натром.
- Какие оксиды могут реагировать между собой? Приведите два уравнения реакции, иллюстрирующих это.
- Какие оксиды реагируют с водой? Что при этом образуется? Приведите два примера уравнений реакций.
- Какие элементы образуют несколько оксидов? Приведите примеры элементов, которые образуют несколько оксидов.
- Получите сернистый газ
 всеми возможными способами. Приведите уравнения реакций.
всеми возможными способами. Приведите уравнения реакций. - Получите оксид кальция всеми возможными способами. Приведите уравнения реакций.
- Могут ли оксиды разных элементов реагировать друг с другом? Ответ мотивируйте.
- Как можно узнать, является ли оксид основным, кислотным или амфотерным?
- Каким основаниям соответствуют: оксид марганца (II), оксид натрия, оксид бария? Составьте формулу оксида и соответствующего основания.
- Каким кислотам соответствуют: оксид фосфора (V), оксид серы (IV), оксид азота (V)?
- Напишите уравнения реакций оксида цинка с соляной кислотой и гидроксидом натрия.
Упражнения
С какими из приведенных веществ будет реагировать указанный оксид? Написать уравнения реакций.
25.  .
.
-
 .
. -
 .
. -
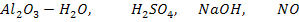 .
. -
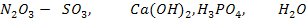 .
. -
 .
. -
 .
. -
 .
. -
 .
. -
 .
. -
 .
. -
 .
. -
 .
. -
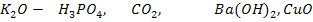 .
. -
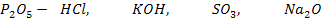 .
. -

Задачи
41. Сколько молекул кислорода содержится в 17,4г оксида марганца (IV)? Какова масса кислорода?
- Где содержится больше кислорода, в 10г оксида натрия или в 10г оксида кальция?
- Сколько молекул фосфора содержится в 20г оксида фосфора (V)?
- В какой массе оксида серы (VI) содержится 2 моль атомов кислорода?
- Где содержится больше молей атомов железа, в 100г
 или в 100г
или в 100г  ?
? - Каково процентное содержание меди и кислорода в оксиде меди (II)?
- В оксиде серы (IV) содержится 6,02•
 атомов кислорода. Каков объём газа при н.у.?
атомов кислорода. Каков объём газа при н.у.? - Где содержится больше молей атомов углерода, в 10л оксида углерода (II) или в 10л оксида углерода (IV)?
- Определить массы веществ образовавшихся при разложении 3 моль гидроксида железа (III).
- При взаимодействии газа с водой образовалось 20г сернистой кислоты. Определить объём (при н.у.) газа и число молей воды вступивших в реакцию.
- При нагревании карбоната кальция образовалось 112г оксида. Определить массу разложившейся соли и объём (при н.у.) образовавшегося газа.
- При взаимодействии газа со щелочью образовалось 5,3г карбоната калия. Сколько молей щелочи и какой объём (при н.у.) газа для этого потребуется?
- Определить массы двух оксидов, необходимые для получения 16,4г фосфата натрия.
- Какая масса оксида потребуется для реакции с 5 молями воды для образования гидроксида калия? Какая масса щелочи при этом получится?
- При взаимодействии газа с основанием образовалось 5,3г карбоната натрия. Сколько молей основания и какой объём (при н.у) газа для этого потребуется?
- При взаимодействии металла с кислородом образовалось 1,204
 молекул оксида алюминия. Сколько молей металла и какой объём кислорода (при н.у.) вступили в реакцию?
молекул оксида алюминия. Сколько молей металла и какой объём кислорода (при н.у.) вступили в реакцию?
Основания
Основания подразделяются на растворимые и нерастворимые, а также на сильные и слабые (с точки зрения электролитической диссоциации).
Основания хорошо растворимые в воде и являющиеся сильными электролитами, называются щелочами.
К ним относятся гидроксиды щелочных металлов, расположенных в таблице Д.И. Менделеева в главной подгруппе первой группы (Li, Na, K, Rb, Cs, Fr), а также гидроксиды щелочно-земельных металлов (Ca, Sr, Ba). Основание  – гидроксид аммония, диссоциирующее по уравнению
– гидроксид аммония, диссоциирующее по уравнению  ,– хорошо растворимо в воде, но проявляет себя как слабый электролит, и не является щелочью.
,– хорошо растворимо в воде, но проявляет себя как слабый электролит, и не является щелочью.
Основания, не относящиеся к щелочам, не растворяются в воде и являются слабыми электролитами.
Основания подразделяются также по количеству гидроксильных групп в молекуле, которое определяется термином “кислотность”. Так, NaOH - однокислотное основание, а 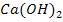 – двухкислотное.
– двухкислотное.
Существуют вещества, формула которых по своей структуре соответствует формуле основания, т.е. 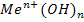 , однако проявляет как свойства оснований, так и кислот, например,
, однако проявляет как свойства оснований, так и кислот, например,  и др. Они называются амфотерными гидроксидами, и им соответствуют рассмотренные ранее амфотерные оксиды (
и др. Они называются амфотерными гидроксидами, и им соответствуют рассмотренные ранее амфотерные оксиды ( . Амфотерные гидроксиды нерастворимы в воде и являются слабыми электролитами.
. Амфотерные гидроксиды нерастворимы в воде и являются слабыми электролитами.
Методы получения оснований
1. Щелочи получают взаимодействием щелочных и щелочно-земельных металлов с водой, при этом выделяется водород
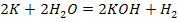
2. Щелочи образуются при взаимодействии соответствующих основных оксидов с водой

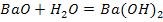
3. Нерастворимые в воде основания и амфотерные гидроксиды получаются обменной реакцией между солью и щелочью

Химические свойства оснований
1. Все основания реагируют с кислотами (реакция нейтрализации) с образованием соли и воды.


2. Основания реагируют с кислотными оксидами (ангидридами кислот) с образованием соли и воды

3. Щелочи взаимодействуют с растворами солей, образуя новый гидроксид и воду

4. Нерастворимые в воде основания разлагаются при нагревании на оксид и воду
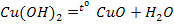

Амфотерные гидроксиды, проявляя основные свойства, в химических реакциях ведут себя так же, как обычные нерастворимые основания.
Проявляя кислотные свойства, амфотерные гидроксиды способны реагировать с щелочами, причем при разных условиях реакции протекают по-разному.
Так, при сплавлении со щелочами получаются безводные соли

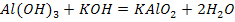
C растворами щелочей амфотерные гидроксиды взаимодействуют с образованием гидроксокомплексных соединений

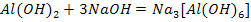
Контрольные задания II
Упражнения
Дайте ответ на вопрос, написав уравнения реакций (№№ 1-8)
1. Даны: натрий, кислород и вода. Получить гидроксид натрия двумя способами.
2. Даны: цинк, кислород, соляная кислота и гидроксид натрия. Получить гидроксид цинка.
3. Исходя из алюминия, получить гидроксид алюминия.
4. Исходя из оксида цинка, получить гидроксид цинка.
5. Исходя из оксида меди(II), получить гидроксид меди(II).
6. Исходя из карбоната кальция, получить гидроксид кальция.
7. Даны: барий, кислород и вода. Получить гидроксид бария двумя способами.
8. Даны: вода, натрий и сульфат железа(III). Получить гидроксид железа(III).
C какими из приведенных веществ реагирует данный гидроксид? Составьте уравнения реакций (№№ 9-24)
9. 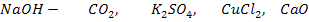
10. 
11. 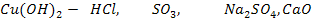
12. 
13. 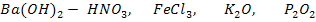
14. 
15. 
16. 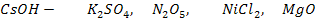
17. 
18. 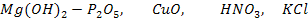
19. 
20. 
21. 
22. 
23. 
24. 
Задачи
25. Сколько граммов метаалюмината калия  образуется при сплавлении гидроксида алюминия с 10 г гидроксида калия?
образуется при сплавлении гидроксида алюминия с 10 г гидроксида калия?
26. Сколько молей сероводорода можно поглотить раствором, содержащим 20 г гидроксида натрия?
27. Сколько граммов оксида алюминия образуется при разложении 3,9 г гидроксида алюминия?
28. При сплавлении едкого натра с диоксидом кремния получилось 6,1 г силиката натрия. Сколько граммов щелочи при этом было израсходовано?
29. Сколько граммов едкого натра образуется при взаимодействии металлического натрия с водой, если при этом выделяется 5,6 л водорода (нормальные условия)?
30. Сколько граммов нитрата бария образуется при взаимодействии 12,6 г азотной кислоты с гидроксидом бария?
31. Сколько граммов оксида железа (III) может образоваться при разложении 5,35 г гидроксида железа (III)?
32. Сколько граммов едкого натра потребуется для полного превращения 8,15 г сульфата цинка в цинкат натрия  ?
?
Кислоты
Кислоты подразделяются на кислородосодержащие и бескислородные. Например, серная (H2SO4) и азотная (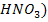 кислоты – кислородосодержащие, а соляная
кислоты – кислородосодержащие, а соляная  и сероводородная
и сероводородная  – бескислородные кислоты.
– бескислородные кислоты.
Кислоты различают по основности. Основность неорганических кислот определяется числом атомов водорода, содержащихся в ее формуле. Эти атомы водорода при реакциях способны замещаться на атомы металла. У органических кислот, которые не рассматриваются в данной работе, часть атомов водорода входит в структуру кислотного остатка и не обменивается с металлами, например, в уксусной кислоте  четыре атома водорода, но она относится к одноосновным кислотам, т.к. только один атом водорода, входящий в группу
четыре атома водорода, но она относится к одноосновным кислотам, т.к. только один атом водорода, входящий в группу
|
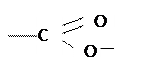 может обмениваться при реакциях с металлами.
может обмениваться при реакциях с металлами.
Кислоты проявляют себя как электролиты разной силы, что характеризуется их степенью диссоциации. У сильных кислот степень диссоциации близка к единице, а у слабых – значительно меньше единицы. Из кислот, перечисленных в таблице 1 раздела II, только пять кислот относят к сильным. Это  Остальные кислоты – слабые.
Остальные кислоты – слабые.
Методы получения кислот
1. Бескислородные кислоты можно получить синтезом водорода и соответствующего неметалла с последующим растворением получившегося газообразного водородного соединения в воде

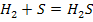
2. Кислородосодержащие кислоты получают взаимодействием кислотных оксидов (ангидридов кислот) с водой

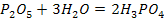
3. Кислоты можно получать действием другой кислоты на соответствующую соль, при этом сильные кислоты вытесняют слабые из их солей
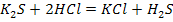

Химические свойства кислот
1. Кислоты взаимодействуют с основаниями с образованием соли и воды (реакция нейтрализации)


2. Кислоты реагируют с основными и амфотерными оксидами с образованием соли и воды


3. Сильные кислоты вытесняют слабые из их солей

4. Кислоты способны реагировать с металлами с образованием соли и выделением водорода

Однако вытеснять водород из кислот могут лишь те металлы, которые стоят в ряду напряжений левее водорода