Гидролиз
Таблица 1. Изменение окраски индикатора в зависимости от концентрации иона водорода.
| ИЗМЕНЕНИЕ ЦВЕТА ИНДИКАТОРА | ||||
| ТИП СОЛИ | ЛАКМУС | ФЕНОЛФТАЛЕИН | МЕТИЛОВЫЙ ОРАНЖЕВЫЙ | СРЕДА |
| сильное основание + слабая кислота | синий | малиновый | жёлтый | щелочная |
| слабое основание +сильная кислота | красный | не изменяется | красный | кислая |
| сильное основание + сильная кислота | не изменяется | не изменяется | не изменяется | нейтральная |
Схема1. Гидролиз солей образованных слабыми кислотами и сильными основаниями- гидролиз по аниону., среда щелочная рН> 7

| 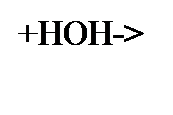 PO4 3- SO3 2- CO3 2- S 2- BO3 3- PO3 3- SiO3 2- AsO43- SnO42- PO4 3- SO3 2- CO3 2- S 2- BO3 3- PO3 3- SiO3 2- AsO43- SnO42-
| 
|  HPO4 2- HSO3 - HCO3 - HS - HBO3 2- HPO3 2- HSiO3- HAsO42- HSnO4- HPO4 2- HSO3 - HCO3 - HS - HBO3 2- HPO3 2- HSiO3- HAsO42- HSnO4-
|
Примечание: Ме (активные, образующие щелочи)- Li, K, Na, Rb, Cs, ,Ba, Sr.
Схема 2. Гидролиз солей образованных сильными кислотами и слабыми основаниями- гидролиз по катиону, среда кислая, рН< 7

|  Cl - Br- I – SO4 2- NO3 - IO3 – ClO3 - ClO4 - MnO4 -CrO42- Cr 2O72- Cl - Br- I – SO4 2- NO3 - IO3 – ClO3 - ClO4 - MnO4 -CrO42- Cr 2O72-
| 
| Cl - Br- I – SO4 2- NO3 - IO3 -ClO3 - ClO4 - MnO4 -CrO42- Cr 2O72- | 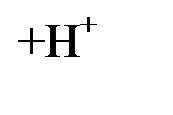
|
Примечание: Ме- Mg…….Au и NH4+
Схема 3. Гидролиз солей образованных слабыми кислотами и слабыми основаниями гидролиз по катиону и аниону- необратимый гидролиз.
В этом случае продуктами гидролиза являются слабые кислота и основание: KtAn + Н2О = KtOH + HAn
Kt+ + An- + H2O = KtOH + Han
где Kt+ и An- - катион и анион слабых основания и кислоты соответственно.
Схема 4.
Соли образованные сильными кислотами и сильными основаниями гидролизу не подвергаются. Среда нейтральная, рН=7
Сильные и слабые электролиты
| Сильные | Слабые |
| 1. Все растворимые соли. | 1. Все труднорастворимые соли. |
2. Неорганические кислоты: 

| 2. Неорганические кислоты: 

|
3. Щелочи: 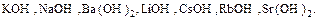
| 3. Амфотерные основания:  4. Неамфотерные гидроксиды:
4. Неамфотерные гидроксиды:  5. Органические кислоты:
5. Органические кислоты:
 6.
6. 
|
|
|
1) Процесс гидролиза является обратимым, протекает не до конца, а только до момента РАВНОВЕСИЯ;
2) Процесс гидролиза – обратный для реакции НЕЙТРАЛИЗАЦИИ, следовательно, гидролиз - эндотермический процесс (протекает с поглощением теплоты).
KF + H2O ⇄ HF + KOH – Q
Какие факторы усиливают гидролиз?
1. Нагревание – при увеличении температуры равновесие смещается в сторону ЭНДОТЕРМИЧЕСКОЙ реакции – гидролиз усиливается;
2. Добавление воды – т.к. вода является исходным веществом в реакции гидролиза, то разбавление раствора усиливает гидролиз.
Как подавить (ослабить) процесс гидролиза?
Часто необходимо не допустить гидролиза. Для этого:
1. Раствор делают максимально концентрированным (уменьшают количество воды);
2. Для смещения равновесия влево добавляют один из продуктов гидролиза – кислоту, если идёт гидролиз по катиону или щёлочь, если идёт гидролиз по аниону.
Гидролиз других соединений, не относящихся к солям.
Бинарные соединения металлов: фосфиды, нитриды, гидриды, карбиды.
При их гидролизе образуется гидроксид металла и водородное соединение неметалла, а из гидрида – водород.
а) гидриды. СаН2 + Н2О = Са(ОН)2 + Н2
б) карбиды: карбиды при гидролизе могут образовывать метан (карбид алюминия, бериллия) или ацетилен (карбиды кальция, щелочных металлов):
Al4C3 + H2O = Al(OH)3 + CH4
(H+OH-)
CaC2 + H2O = Ca(OH)2 + C2H2
в) остальные бинарные соединения: нитриды (выделяется аммиак), фосфиды (образуется фосфин), силициды (получается силан).
Са3Р2 + Н2О = РН3 + Са(ОН)2