ОБЪЁМ И ТЕПЛОЁМКОСТЬ ТЕЛА ЯВЛЯЮТСЯ
Теплоемкстьколичествотеплоты, необходимое для нагреваединицыколичествавещества на 1 градус в данномпроцессе.
Экстенсивныесвойства
5. ДАВЛЕНИЕ, УДЕЛЬНЫЙ ОБЪЁМ И ТЕМПЕРАТУРА ЯВЛЯЮТСЯ
Термическими параметрами, интенсивные свойства
УСТАНОВИТЕ СООТВЕТСТВИЕ МЕЖДУ НАИМЕНОВАНИЯМИ СВОЙСТВ, ИХ ОБОЗНАЧЕНИЯМИ И РАЗМЕРНОСТЯМИ В СИСТЕМЕ СИ
давление измеряется в Н/м2=Па (Паскаль).
Атмосферное давле-ние (барометрическое) примерно равно 105 Па, поэто-му на практике используются следующие системные единицы измерения:
1000 Па = 1 кПа, 106 Па = 1 МПа.
Внесистемной единицей является 1бар= 105 Па. Нор-мальное атмосферное давление принимается равным:
1 атм = 760 мм рт. ст. = 1,01325 бар = 0,101325 МПа.
В метрической системе единиц использовалась техни-ческая атмосфера: 1 ат = 1 кГ/см2 = 0,980665 бар.
Удельный объём — это объём единицы массы ве-щества (м3/кг)бсолютное давление в Н/м2 = Па
Величина, обратная удельному объёму ρ = 1/ v, есть плотность — масса единицы объёма вещества(кг/м3).
Количество вещества можно задавать единицами массы (кг), числом молей (моль)
В системе СИ для измерения температуры ис-пользуются две шкалы — стоградусная Цельсия и термодинамическая (абсолютная) Кельвина.
R, Дж/(кг.К) — удельная газовая постоянная, ин-дивидуальная для каждого вещества.
R, Дж/(моль К) — универсальная газовая посто-янная
Общее количество теплоты, подведенное к телу (либо отведенное от него), обозначается Q [Дж], а удельное — q [Дж/кг].
В метрической системе в качестве единицы коли-чества теплоты применялась калория — теплота, не-обходимая для нагрева одного грамма воды от 19,5 до 20,5ºС: 1 кал = 4,1868 Дж.
Соответственно различают массовую, мольную и объёмную теплоёмкости; их размерности: Дж/(кг К), Дж(/моль К) и Дж/(нм3К).
внутренней энергией и обозначают u; размерность u такая же, как q и l — Дж/кг.энтропия обозначается S размерность [Дж/К]
7. ПОКАЗАНИЯ МАНОМЕТРА СООТВЕТСТВУЮТ
pизб, pман — избыточное давление(по манометру);
8. ПОКАЗАНИЯ ВАКУУММЕТРА СООТВЕТСТВУЮТ
pраз, pвак — разрежение (показание вакуумметра).
9. ЕСЛИt = t2 - t1, аT = T2 - T1, ТО
10. 10 кГ/см2 В ЕДИНИЦАХ СИ РАВНЫ
9,80665 бар (105кг/м2)
11. 10 атм В ЕДИНИЦАХ СИ РАВНЫ
1013250 Па
Тема №2
12. УРАВНЕНИЕ СОСТОЯНИЯ СВЯЗЫВАЕТ
Между термическими параметрами рабочего тела в равновесных состояниях существует взаимосвязь: v=f(p,T) либо F(p,v,T)=0. Уравнение, связывающее любой термодинамический параметр системы с её независимыми параметрами называется уравнением состояния (УС).
13. УРАВНЕНИЕ КЛАПЕЙРОНА СВЯЗЫВАЕТ
Равновесные состояния идеального газа описыва-ет уравнение Клапейрона
pv = RT, (1.5)
где R, Дж/(кг.К) — удельная газовая постоянная, ин-дивидуальная для каждого вещества.
Для произвольного количества рабочего тела (М килограмм) уравнение (1.5) преобразуется к виду:
pV = MRT. (1.6)
Умножив обе части УС (1.5) на относительную молекулярную массу μ, получим уравнение Клапейрона– Менделеева:
pvμ = μRT либо pVμ = RμT, (1.7)
где R, Дж/(моль К) — универсальная газовая посто-янная, её значение рассчитывается по данным о пара-метрах газа при нормальных условиях
В УРАВНЕНИИ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА ФИГУРИРУЕТ
 ,
,
15. В СООТВЕТСТВИИ С ЗАКОНОМ ДАЛЬТОНА ПОЛНОЕ ДАВЛЕНИЕ СМЕСИ ИДЕАЛЬНЫХ ГАЗОВ РАВНО
сумме парциальных давлений pi компонентов смеси
 . .
|
16. ТЕРМОДИНАМИЧЕСКИЙ ПРОЦЕСС - ЭТО ИЗМЕНЕНИЕ СОСТОЯНИЯ
СИСТЕМЫ, ХАРАКТЕРИЗУЮЩЕЕСЯ ИЗМЕНЕНИЕМ ЕЁ
параметров и подчиняющееся определённой законо-мерности.
ТЕРМОДИНАМИЧЕСКИЙ ПРОЦЕСС ЛЮБОЙ КОНФИГУРАЦИИ ВОЗМОЖЕН ПОТОМУ, ЧТО НА РАБОЧЕЕ ТЕЛО ОКАЗЫВАЮТСЯ ДВА ВОЗДЕЙСТВИЯ
При исследовании процесса определяют измене-ние параметров рабочего тела, работу l и теплоту q. (внутр энергия)
18. РАВНОВЕСНЫЙ ПРОЦЕСС ПРОТЕКАЕТ
непрерывная последовательность равновесных состояний. Он протекает бесконечно медленно, при бесконечно малой разности между параметрами рабочего тела и окружающей среды.
19. НЕРАВНОВЕСНЫЙ ПРОЦЕСС ВКЛЮЧАЕТ
Неравновесный процесс — последовательность состояний, среди которых есть неравновесные.
20. ТЕРМОДИНАМИЧЕСКИЙ ПРОЦЕСС ЗАДАН, ЕСЛИ ИЗВЕСТНЫ
заданы уравнения двух его проекций либо уравнение состояния тела (уравнение поверхности) и уравнение одной проекции процесса.
21. ДЕФОРМАЦИОННАЯ РАБОТА ИЗОБРАЖАЕТСЯ В ВИДЕ ПЛОЩАДИ НА ДИАГРАММЕ
Диаграмму p,v называют рабочей, в ней работа изоб-ражается площадью под кривой процесса
22. ДЕФОРМАЦИОННАЯ РАБОТА ПРАВИЛЬНО ИЗОБРАЖЕНА В ВИДЕ
ПЛОЩАДИ НА ДИАГРАММЕ

Работа сил давления при равновесном процессе расширения (а); определение деформационной работых (б); зависимость работы от процесса (в).
23. АНАЛИТИЧЕСКОЕ ВЫРАЖЕНИЕ ПЕРВОГО ЗАКОНА ТЕРМОДИНАМИКИ
ДЛЯ ЛЮБЫХ ПРОЦЕССОВ ИМЕЕТ ВИД
в круговых процессах теплота и работа эквивалентны
Qкруг = Lкруг.
24. АНАЛИТИЧЕСКОЕ ВЫРАЖЕНИЕ ПЕРВОГО ЗАКОНА ТЕРМОДИНАМИКИ ДЛЯ РАВНОВЕСНЫХ ПРОЦЕССОВ С ЛЮБЫМ ГАЗОМ ИМЕЕТ ВИД
Для равновесных процессов  и уравнение принимает вид
и уравнение принимает вид
 . .
|
25. ОСНОВНОЕ УРАВНЕНИЕ ТЕРМОДИНАМИКИ ДЛЯ СТАЦИОНАРНОГО
ПОТОКА ГАЗА ИМЕЕТ ВИД
 . .
|
26. ВЫРАЖЕНИЕ ДЛЯ ТЕХНИЧЕСКОЙ РАБОТЫИМЕЕТ ВИД
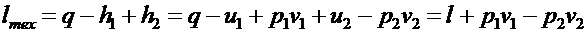 .
.
27. ВЫРАЖЕНИЕ ДЛЯ ТЕХНИЧЕСКОЙ РАБОТЫИМЕЕТ ВИД

28. УРАВНЕНИЕ ПЕРВОГО ЗАКОНА ТЕРМОДИНАМИКИ ДЛЯ ИДЕАЛЬНОГО
ГАЗА ИМЕЕТ ВИД
 .
.
Для идеального газа (∂ u 0/∂ v) T = 0, и уравнение принимает вид
 , ,
| |
 . .
| (2. |
Для идеального газа (∂ h 0/∂ p) T = 0, и следовательно
 . .
| (2. |
29. ВЫРАЖЕНИЕ ДЛЯ ЭНТРОПИИ ИДЕАЛЬНОГО ГАЗА ИМЕЕТ ВИД
 .
.
30. ВЫРАЖЕНИЕ ДЛЯ ИЗМЕНЕНИЯ ЭНТРОПИИ ИДЕАЛЬНОГО ГАЗА ИМЕЕТ ВИД
 .
.
31. ТЕПЛОТА ПРОЦЕССА ИЗОБРАЖАЕТСЯ В ВИДЕ ПЛОЩАДИ НА
ДИАГРАММЕ
Следовательно, в координатах T,s теплота изображается площадью под кривой процесса
32. ТЕПЛОТА ПРОЦЕССА ПРАВИЛЬНО ИЗОБРАЖЕНА В ВИДЕ ПЛОЩАДИ
НА ДИАГРАММЕ
Изобразим процесс на диаграмме T,s (рис. 3.3 г). Теплота процесса равна
 . .
|
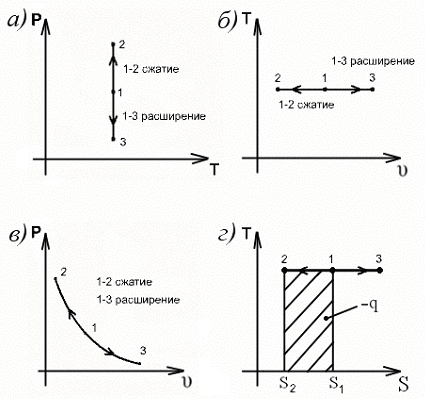
33. ТЕПЛОЁМКОСТЬ ПРОЦЕССА В ДАННОЙ ТОЧКЕ МОЖЕТ БЫТЬ ИЗОБРАЖЕНА КАК
Изобара, проходящая через общую с изохорой точку, в координатах T,s более пологая кривая, чем изохора (рис.3.2 д), так как в соответствии со вторым свойством диаграммы T,s теплоёмкость изображается подкасательной к кривой процесса, а ср>сv.
34. ТЕПЛОЁМКОСТЬ ПРОЦЕССА В ДАННОЙ ТОЧКЕ ПРАВИЛЬНО
ИЗОБРАЖЕНА НА ДИАГРАММЕ
С, Т 
Тема №4
35. КАКОЕ ИЗ ПРЕДСТАВЛЕННЫХ СООТНОШЕНИЙ СПРАВЕДЛИВО ДЛЯ
ИЗОХОРНОГО ПРОЦЕССА В ИДЕАЛЬНОМ ГАЗЕ?
 .
.
 ,
,
36. КАКОЙ ИЗ УКАЗАННЫХ НАБОРОВ ДАННЫХ ПОЗВОЛЯЕТ ВЫЧИСЛИТЬ ТЕХНИЧЕСКУЮ РАБОТУ ИДЕАЛЬНОГО ГАЗА В ПРОЦЕССЕ V=CONST?
 .
.
37. КАКОЕ ИЗ ПРЕДСТАВЛЕННЫХ СООТНОШЕНИЙ СПРАВЕДЛИВО ДЛЯ
ИЗОБАРНОГО ПРОЦЕССА В ИДЕАЛЬНОМ ГАЗЕ?
 ,
,
38. КАКОЙ ИЗ УКАЗАННЫХ НАБОРОВ ДАННЫХ ПОЗВОЛЯЕТ ВЫЧИСЛИТЬ
ДЕФОРМАЦИОННУЮ РАБОТУ ИДЕАЛЬНОГО ГАЗА В ПРОЦЕССЕ P=CONST
 .
.
39. ДЛЯ КАКИХ ПРОЦЕССОВ СПРАВЕДЛИВО СООТНОШЕНИЕ lтех = h1 - h2?
Адиабатный процесс