ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ БРАЗОВАТЕЛЬНОЕ
УЧРЕЖДЕНИЕ ВЫСШЕГО ОБРАЗОВАНИЯ
«ОМСКИЙ ГОСУДАРСТВЕННЫЙ АГРАРНЫЙ УНИВЕРСИТЕТ
Им. П.А. СТОЛЫПИНА»
ФАКУЛЬТЕТ АГРОХИМИИ, ПОЧВОВЕДЕНИЯ, ЭКОЛОГИИ, ПРИРОДООБУСТРОЙСТВА И ВОДОПОЛЬЗОВАНИЯ
Кафедра агрохимии и почвоведения
ОП по направлению 35.03.03 – Агрохимия и агропочвоведение
РЕФЕРАТ
по дисциплине «Инструментальные методы исследования в агрохимии»
на тему: «МЕТОДЫАНАЛИЗА ЭКОТОКСИКАНТОВ В ПОЧВАХ И РАСТЕНИЯХ»
Реферат на тему:
«Методы, используемые при анализе компонентов почвы: кислотности актуальной, потенциальной, гидролитической, реакции среды».
Выполнил: студент 202 группы
Аннамырадов Эзиз
Проверила: Трубина Н.К.
Омск-2016г.
Содержание:
1. Кислотность почвы
1.1.Оцека кислых почв
1.2.Как исправить кислотность почв
2. Виды кислотности
3. Методы определения почвы на кислотность
4. Лабораторный метод определения свойств почвы (определение рН)
5. Приложение 1
Список литературы
Кислотность почвы
Кислотность почвы — способность почвы проявлять свойства кислот.
Наличие ионов водорода (Н-ионов) в почвенном растворе, а также обменных ионов водорода и алюминия в почвенном поглощающем комплексе при неполной нейтрализации придаёт почве кислую реакцию.
Реакцию почвы характеризуют величиной рН, представляющей собой отрицательный логарифм активности ионов водорода. При увеличении концентрации Н+ величина рН снижается, а когда концентрация Н+-ионов уменьшается, величина рН возрастает.
Кислотность почв - способность почв нейтрализовать компоненты щелочной природы, подкислять воду и растворы нейтральных солей.
Подкисление почвы — изменение кислотно-основных свойств почвы, вызванное природным почвообразовательным процессом, поступлением загрязняющих веществ, внесением физиологически кислых удобрений и другими видами антропогенного воздействия.
От кислотности почвы зависит проявление свойств кислот, которые попадают, образуются и преобразуются в почве, а, следовательно, от этого зависит развитие самих растений и влияние на плодородие почвы. Кислотность влияет на структуру почвы (величину и прочность почвенных частиц), на вносимые органические и минеральные удобрения, микрофлору почвы, образование гумусовых кислот, распад и синтез минералов. На кислых почвах многие агрохимические показатели изменяются в неблагоприятную сторону. В результате потери кальция нарушается структура почвы, ухудшаются условия для развития полезных бактерий, в первую очередь тех, которые накапливают в почве минеральный азот. Питательные вещества, главным образом фосфор, переходят в трудноусвояемое состояние. В кислой почве накапливаются в повышенных количествах растворимые алюминий, железо, марганец, что оказывает вредное влияние на растения и микроорганизмы. При повышенной кислотности снижается поступление в растения азота, калия, кальция, магния.
По степени кислотности почвы делятся на:
- сильнокислые (<4,5),
- среднекислые (4,6-5),
- слабокислые (5,1-5,5),
- близкие к нейтральным (5,6-6,4),
- нейтральные (6,5-7,3),
- слабощелочные (7,4-8),
- щелочные (8,1-8,5),
- сильнощелочные (>8,5).
При рН равном 7 реакция почвенного раствора нейтральная, то есть концентрация ионов водорода (Н+) и гидроксидов (ОН-) одинаковая. Если в почве преобладают ионы Н+, то она кислая, а если в ней больше ионов ОН-, то она щелочная.
Реакция среды различных почв колеблется в широких пределах. Кислая и сильнокислая реакция среды свойственна красноземам, желтоземам, подзолистым и торфянисто-подзолистым почвам, торфу верховых болот. Сильнощелочную реакцию среды имеют многонатриевые солонцы и содовые солончаки, нейтральную — черноземы, темно-серые лесные и темно-каштановые почвы.
Кислые почвы, как правило, бесструктурные, имеют неудовлетворительные водно-воздушные свойства. Они вредны для растений и полезной микрофлоры, затрудняют поступление кальция, магния и молибдена в растения, сосуды корневых волосков закупориваются, подавляется азотофиксация бобовых растений. Избыточная кислотность увеличивает до токсичных количеств содержание в почве подвижных ионов алюминия и марганца.
Щелочные почвы также угнетают деятельность микроорганизмов, ухудшают структуру и физические свойства почвы, режим питания растений. Сильно падает доступность растениям фосфора, калия, железа, меди, бора, магния, цинка; ухудшаются фильтрация, капиллярность, проницаемость, набухаемость почвы. Устраняют избыточную щелочность гипсованием.
Оценка кислых почв.
Кислые почвы являются основным компонентом почвенного покрова в бореальном (умеренно-холодном) поясе, влажных тропиках и субтропиках. Кислые почвы формируются в условиях водного режима промывного типа, который способствует выносу из почвы щелочных и щелочно-земельных оснований и насыщению ППК (почвенно-поглощающий комплекс) водородом.
Почвы с кислой реакцией среды занимают значительные площади на территории России. В последнее время наблюдается закисление пахотных почв, т. е. снижается доля слабокислых почв и увеличиваются площади, занятые средне- и сильнокислыми почвами. Главная причина этого резкое сокращение объемов мелиоративных работ (известкование). Кислотность почв постепенно развивается в результате выщелачивания кальция атмосферными осадками. Также происходит при применении физиологически кислых удобрений без последующего известкования.
В кислых почвах создаются неблагоприятные условия для роста и развития большинства сельскохозяйственных культур, что ведет к снижению их урожайности. В кислой среде угнетаются аммонификация, замедляется фиксация азота из воздуха, ухудшается азотный режим почвы. Складывается неблагоприятный фосфатный режим, что обусловлено связыванием фосфора соединениями железа и алюминия, в результате чего он переходит в труднодоступное для растений состояние. Возрастает растворимость и подвижность бора, меди, цинка, кобальта и других микроэлементов. Повышенное содержание их в подвижных формах в почве часто оказывает токсическое действие на растения. Из-за высокой кислотности снижается доступность растениям такого важного микроэлемента, как молибден. В кислой среде ухудшаются условия гумусообразования, что ведет к преимущественному накоплению фульвокислот и низкомолекулярных органических соединений, менее ценных, чем гуминовые кислоты.
Как исправить кислотность почв
Для устранения избыточной кислотности почву известкуют. Поступающий с известью кальций нейтрализует кислотность почвы. Чтобы правильно определить дозу извести, необходимо знать величину рН, механический состав почвы и чувствительность отдельных культур к кислотности.
Основное известковое удобрение — молотый известняк, в котором содержится 100% чистого карбоната кальция (СаСО3). Кроме молотого известняка для известкования используют:
· гашеная известь (пушонка)
· цементная пыль
· доменные молотые шлаки
· мартеновский шлак
· карбидная известь
· дефекат (отход сахарной промышленности)
· сланцевая зола
· все виды растительной золы
Известкование проводят осенью или весной раз в 6—8 лет. Если вносят неполную дозу, то известкование повторяют через 3—4 года. При систематическом использовании органических удобрений повторного известкования можно не проводить
Непременным условием повышения эффективности известкования является хороший контакт частиц известкового материала с почвой. Для этого известь равномерно разбрасывают по поверхности почвы, перекапывают на глубину пахотного слоя и тщательно перемешивают.
Внесение продукции с Эффективными Микроорганизмами нормализует состав почвы. Если регулярно применять ЭМ совместно с сидератами, через четыре года весь грунт на участке будет иметь нормальную реакцию. Сидераты: бобовые, люпин, рожь, фацелия, вика, овёс. Они обогащают почву азотом и микроэлементами.
Повышает кислотность почвы угольная кислота, образующаяся при растворении углекислого газа, гуминовые и фульвокислоты, появляются при разложении остатков хвойной и моховой растительности. В результате жизнедеятельности грибов и бактерий, разложения растительного опада, корней и насекомых в почве могут присутствовать свободные органические кислоты типа уксусной, щавелевой, лимонной. А в некоторых случаях (при выветривании горных пород и минералов) образуются и сильные минеральные кислоты - соляная, серная. Повышают кислотность и вносимые физиологически кислые удобрения - аммиачная селитра, хлористый калий, азотнокислый аммонии и другие.
Виды кислотности
В зависимости от того, в каком состоянии находятся в почве ионы водорода, различают актуальную (активную) и потенциальную (скрытую) кислотность с подразделением последней на обменную и гидролитическую.
Актуальная кислотность. Представляет собой кислотность почвенного раствора. Важнейшую роль в формировании актуальной кислотности в большинстве случаев играет угольная кислота. В зависимости от термодинамических условий и биологической активности почв она поддерживает рН почвы в пределах от 3,9 до 5,7. Режим углекислоты в почвах тесно связан с суточно-сезонными ритмами погоды и активностью микроорганизмов.
Свободные минеральные кислоты: серная, азотная и другие, в больших количествах редко присутствуют в почвах. В то же время активная деятельность нитрифицирующих микроорганизмов способствует появлению на короткое время в почвенном растворе азотной и азотистой кислот, что вызывает снижение рН на 0,5-2,0. При разложении белковых соединений под воздействием микроорганизмов в почвенный раствор в небольшом количестве поступает серная кислота.
Кислотность почвенных растворов может быть обусловлена наличием в них свободных органических кислот, в том числе гумусовых, а также различных компонентов, проявляющих кислотные свойства. В числе последних представляются аквакомплексы двух- и особенно трехвалентных катионов.
Растения также могут служить источником ионов водорода, так как в процессе жизнедеятельности они потребляют различные катионы, а продуцируют в почву эквивалентное количество Н+-ионов.
Потенциальная кислотность. Эта форма кислотности имеет сложную природу. Её носителями являются обменные катионы H+ и Al3+. Потенциальная кислотность проявляется при взаимодействии почвы с растворами солей, когда катион соли вытесняет ионы H+ и Al3+ из обменно-поглощенного состояния в почвенный раствор. Потенциальная кислотность дает представление о всей совокупности компонентов с кислотными свойствами, находящихся в почвенном растворе и в твердой фазе почвы. Разделение потенциальной кислотности на обменную и гидролитическую в общих чертах характеризует последовательные этапы выделения в раствор дополнительных количеств протонов, связанных с твердой фазой почвы.
Обменная кислотность проявляется при обработке почвы раствором нейтральной соли, обычно 1 н. KCl, при этом происходит эквивалентный обмен катионов нейтральной соли на катионы водорода и алюминия.
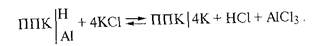
В результате обменных реакций образуется соль AlCl3, которая затем гидролитически расщепляется в водородном растворе:

Таким образом, после обработки почвы, содержащей в обменно-поглощенном состоянии H и Al, раствором нейтральной соли к ионам водорода почвенного раствора добавляются ионы, вытесненные из ППК и образовавшиеся в результате гидролитического расщепления AlCl3. Следовательно, в кислых почвах рН солевого раствора всегда будет меньше, чем рН водного раствора.
Важную роль в раскрытии природы обменной кислотности сыграло установление способности самопроизвольного перехода (превращения) почв, насыщенных ионом Н, в почвы, насыщенные Al, т. е. осуществление самопроизвольной реакции: Н-почвы Al-почвы.
Однако Н-почвы неустойчивы и переходят в Al-почвы, из которых ион Al вновь вытесняется катионами щелочных и щелочноземельных оснований, поступающих в почвенный раствор при разложении растительного опада. Часть кристаллической решетки алюмосиликатов при этом разрушается. Такие циклы превращений периодически повторяются, что и влечет за собой прогрессирующее разложение алюмосиликатной части почвы и проявления подзолистого процесса.
Таким образом, ППК кислых почв всегда содержит небольшое количество обменных Н и Al. Как правило, в малогумусных горизонтах кислых почв (подзолистых, дерново-подзолистых, серых лесных) обменная кислотность в основном обусловлена обменными ионами Al3+ нежели Н+. Наоборот, в гумусовых горизонтах обменный Н преобладает над обменным Al. Причем обменный Al может вообще отсутствовать, т. е. обменная кислотность будет полностью обусловлена ионами Н.
Гидролитическая кислотность, как правило, больше обменной. Более полное вытеснение ионов водорода и других кислотных ионов проявляется при взаимодействии почвы с раствором гидролитически щелочной соли, например CH3COONa:

В данном случае более полное протекание реакции обусловлено связыванием водорода в слабодиссоциированную уксусную кислоту и большей степенью гидролиза солей алюминия с образованием Al(OH)3 и иона Н. Гидролитическую кислотность рассматривают как суммарную кислотность почвы, состоящую из актуальной и потенциальной кислотности, и выражается в мг-экв/100 г почвы. В некоторых случаях гидролитическая кислотность бывает меньше обменной. Это характерно для почв, богатых положительно заряженными коллоидами. В этом случае наблюдается поглощение коллоидами анионов уксусной кислоты и замещение их на ион ОН, что уменьшает кислотность почвенных вытяжек.
Величину гидролитической кислотности используют для нахождения дозы извести, необходимой для устранения кислотности, и расчета насыщенности почвы основаниями.