Тест «Кинетика»
Билет №0
1.В каком случае скорость прямой реакции не будет зависить от концентрации реагирующих веществ:
а) Al2O3(т)+3SO3(г) 
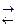 Al2(SO4)3(т)
Al2(SO4)3(т)
б) Al2O3(т)+Na2O(т) 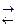 2NaAlO2(т)
2NaAlO2(т)
в) 2NaF(т)+Cl2(г) 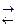 2NaCl(т)+F2(г)
2NaCl(т)+F2(г)
2. Как изменится скорость прямой реакции

 2SО2(г) + О2(г) 2SО3(г),
2SО2(г) + О2(г) 2SО3(г),
если общее давление в системе уменьшить в 3 раз?
а) уменьшится в 6 раз
б) уменьшится в 18 раз
в) увеличится в 18 раз
г) уменьшится в 27 раз
д) увеличится в 27 раз
3. При температуре 600 С скорость реакции равна 0,64 моль/л.с. Какова скорость реакции (моль/л.с.) при 200С? Температурный коэффициент скорости реакции равен 3.
а) 0,127 моль/л.с. б) 0,008 моль/л.с. в) 0,053 моль/л.с. г) 7,68 моль/л.с.
4. На рисунке показана энергетическая диаграмма двух различных механизмов для одной и той же реакции. Укажите энергию активации прямой реакции, идущей без катализатора
а) А
б) Б
в) Г
г) В

5. Для какой реакции понижение температуры и давления сместит равновесие в одном направлении:

 1) 2СО(г) СО2(г) + С(к)
1) 2СО(г) СО2(г) + С(к)  Н10 = -172,5 кДж
Н10 = -172,5 кДж

 2) Н2(г) + В2(г) 2НВ(г)
2) Н2(г) + В2(г) 2НВ(г)  Н20 = -72,5 кДж
Н20 = -72,5 кДж
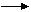
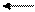 3) 2НCl(г) + О2(г) 2Н2О(г) + 2Cl2(г)
3) 2НCl(г) + О2(г) 2Н2О(г) + 2Cl2(г)  Н30 = -114,5 кДж?
Н30 = -114,5 кДж?
6. Химическое равновесие реакции

 СО2(г) + Н2(г) СО(г) + Н2О(г) установилось при следующих концентрациях реагирующих веществ (моль/л): [СО2]= 7 [Н2]= 5 [СО] = 10 [Н2О] = 14
СО2(г) + Н2(г) СО(г) + Н2О(г) установилось при следующих концентрациях реагирующих веществ (моль/л): [СО2]= 7 [Н2]= 5 [СО] = 10 [Н2О] = 14
1) Вычислите константу равновесия
2) Определите состав и концентрацию веществ в исходной смеси.
Варианты решения некоторых задач.
Задача на З.Д.М. (закон действующих масс): зависимость скорости реакции от концентрации веществ
аА+bB  mM+nN
mM+nN
Если реакция гомогенная, то есть все вещества газы или все вещества жидкости, то математическая записьЗ.Д.М.:


[ ] – это обозначение молярной концентрации в данный момент времени.
В З.Д.М. учитывается концентрация только газов, а если их нет, то только жидкостей, твердые не учитываются никогда.
Если не указано, для какой реакции следует оценить изменение скорости, то следует отвечать для прямой реакции.
Если реагирующие вещества газы, то изменить концентрацию можно, изменяя давление.
Если реагирующие вещества газы или жидкости, то изменить концентрацию можно, изменяя объем.
Если ↑P(увеличиваем давление) в n раз,
то ↓V (уменьшается объем) в n раз,
то и концентрации ([ ])каждого вещества, записанного в З.Д.М.)↑(увеличиваются) в n раз,
а Ѵ (скорость) ↑(увеличивается) в na+b+… раз.
↑- увеличиваем или увеличивается
↓- уменьшаем или уменьшается
a, b – степени у концентрации веществ в З.Д.М., они равны коэффициентам перед веществами в уравнении реакции.
Пример 1. Как изменится скорость реакции, если
а) ↑Р (увеличить давление) в 3 раза
б) ↑V (увеличить объем) в 4 раза
в) ↑[N2] (увеличить концентрацию азота) в 10 раз
г) ↓[H2] (уменьшить концентрацию водорода) в 2 раза.
(Примечание: если в задаче говорится про изменение концентрации только одного из реагирующих веществ, то концентрации других веществ остаются неизменными).
Решение.
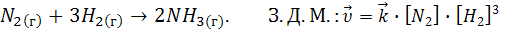
а)
до изменения
[N2]=x моль/л
[H2]=y моль/л

| а)Р↑→[всех]↑
[N2]=3x
[H2]=3y


|
б)
до изменения
[N2]=x моль/л
[H2]=y моль/л

| б)V↑→[всех]↓


 

|
в)
до изменения
[N2]=x моль/л
[H2]=y моль/л

| в)
[N2]=10x
[H2]=y


|
г)
до изменения
[N2]=x моль/л
[H2]=y моль/л

| г)
[N2]=10x
[H2]= 


|
Ответ: а) скорость реакции увеличится в 81раз
б) скорость реакции уменьшится в 265 раз
в) скорость реакции увеличится в 10 раз
г) скорость реакции уменьшится в 8 раз.
Пример 2. Как надо изменить
1) давление в системе, чтобы скорость реакции ↑(возросла) в 125 раз
2) концентрацию O2, чтобы при ↑[NO] (при увеличении концентрации NO) в 3 раза скорость реакции осталась без изменения
Решение.

До изменения
[NO]=x моль/л
[O2]=y моль/л

| 1)т.к. скорость ↑ → P↑ в n раз.
[NO]=nx
[O2]=ny

 125=
125=  n=5 → давление следует ↑ в 5 раз.
n=5 → давление следует ↑ в 5 раз.
| 2) [NO]=3x
[O2]=ny


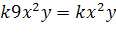 9n=1
n=1/9
→ [O2] надо ↓ в 9 раз.
9n=1
n=1/9
→ [O2] надо ↓ в 9 раз.
|
Ответ:1) чтобы скорость данной реакции увеличилась в 125 раз, давление в системе надо увеличить в 5 раз
2) чтобы скорость реакции осталась неизменной при увеличении концентрации NO в 3 раза, концентрацию O2 надо уменьшить в 9 раз.