Понятие о теплоемкости
Теплоёмкостью тела называется количество тепла необходимое для нагрева тела на один градус. Удельная теплоемкость – теплоёмкость единицы количества вещества.
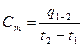
Теплоемкость является функцией температуры [C=f(t)], поэтому истинная теплоемкость равна
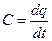 , следовательно q1-2=∫c×dt
, следовательно q1-2=∫c×dt
Массовая теплоемкость – количество тепла необходимое для изменения температуры единицы массы вещества на один градус.
Объемная теплоемкость – то же самое отнесенное к единице объема вещества.
В зависимости от процесса количество тепла для нагрева тела на один градус будет различным. Поэтому на практике используют теплоемкости изобарного и изохорного процессов и называют их соответственно Cp и Cv.
5. Эквивалентность теплоты и работы.
Понятие теплоты близко к понятию работы – и то и другое является формой передачи энергии.
Теплота представляет такую форму передачи энергии, которая определяется либо непосредственным контактом между телами (теплопроводность, конвекция), либо лучистым переносом энергии.
В случае механической работы обязательно имеет место изменение объема тела.
Джоуль (1843-1890) установил, что между затраченной работой (L) и количеством подведенного тепла (Q) существует прямая пропорциональность
Q = A×L
где – А- тепловой эквивалент работы (А=0,002345 ккал/(кгс∙м)); 1/А=I - механический эквивалент тепла (I=427 кгс/ккал).
1 калория –количество тепла необходимое для нагрева 1г воды с 14,5 до 15,50С (так называемая 15 градусная калория).
В настоящее время применяются различные единицы:
1Дж; 1эрг =10-7Дж; 1кгс∙м= 9,80665 Дж; 1ккал =4186,8 Дж;
1 квт∙ч=3,6∙106 Дж.
6. Внутренняя энергия и внешняя работа.
Первый закон термодинамики.
Рассмотрим процесс нагрева некоторого объема горной породы, находящейся внутри массива (рис. 1.1).
При нагревании выделенного объема его температура будет повышаться и, согласно закону сохранения энергии, будет возрастать его внутренняя энергия и совершаться внешняя работа.
Внутренняя энергия U(Дж) выделенного объема складывается из энергии поступательного и вращательного движения молекул, составляющих минералы, энергии внутримолекулярных колебаний, потенциальной энергии сил сцепления между молекулами.
Часть внутренней энергии выделенного объема горной породы при нагреве переходит в свободную энергию (энергия разрыва межзерновых связей в неоднородных породах за счет внутренних термических напряжений, возникающих на границах минеральных зерен, в связи с различными значениями их модулей упругости и коэффициентов теплового расширения).
Внутренняя энергия термодинамической системы зависит только от параметров состояния и не зависит от того, каким путем изменялись эти параметры. Внутренняя энергия является экстенсивной характеристикой, так как она пропорциональна количеству вещества в термодина-ми-ческой системе. 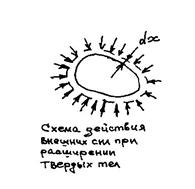
Величина u=U/G (Дж/кг) называется удель-ной внутренней энергией и представляет собой внутреннюю энергию единицы массы вещества, которая является интенсивным параметром. Как и все экстенсивные параметры, внутренняя энергия является аддитивной величиной (аддитивными называются величины, для которых выполняется условие системы)
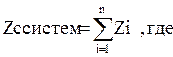
n – число составляющих частей системы). Интенсивные величины свойством аддитивности не обладают.
Начало отсчета внутренней энергии можно выбрать произвольно. Величина внутренней энергии термодинамической системы однозначно определяется, если заданы любых два параметра состояния, т. е.
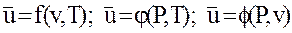 (1.8)
(1.8)
Дифференциал внутренней энергии представляет собой полный дифференциал, который, например, для функции u=f(v, Т) имеет вид
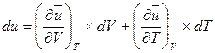 (1.9)
(1.9)
где индексы у частных производных означают, что они взяты при постоянстве той величины, которая стоит в виде индекса. - Дифференциалы таких функций, как тепло и работа, не являются полными дифференциалами и представляют собой просто бесконечно малые величины.
При нагревании выделенного объема горной породы (см. рис. 1.1) он будет расширяться. Если предположить, что давление окружающего массива равно Р, то увеличение выделенного объема будет сопровождаться работой против сил внешнего давления, которая называется внешней работой.
Обозначим поверхность выделенного объема через F, изменение объема через dV, перемещение каждой точки поверхности выделенного объема через dx. Учитывая, что давление—это сила, действующая по нормали на единицу поверхности выделенного объема, следует, что
Pc=P∙F, (1.10)
где Рс—суммарная сила, действующая на всю поверхность выделенного объема породы F.
В данном случае внешняя работа представляет собой работу расширения dA выделенного объема породы против сил внешнего давления:
dA=Pc ∙dx=P∙F∙dx (1.11)
Так как Fdx= dV, то dA=P∙dV, (1.12)
или для конечного процесса 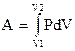 (1.13)
(1.13)
Работа расширения совершается только в том случае, когда происходит изменение объема породы. Эту работу можно определить с помощью Р, V-диаграммы (рис. 1.2), которая выделена штриховкой.
Работа расширения при переходе термодинам 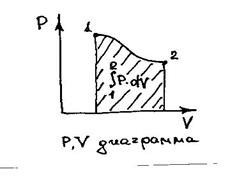 ической системы из состояния 1 в состояние 2 зависит не только от параметров этих состояний, но и от того, по какому пути осуществляется процесс расширения при переходе системы из одного состояния в другое. Кроме работы расширения в данном примере осуществляется работа по увеличению поверхности объема породы. Эта работа затрачивается на преодоление сил поверхностного натяжения.
ической системы из состояния 1 в состояние 2 зависит не только от параметров этих состояний, но и от того, по какому пути осуществляется процесс расширения при переходе системы из одного состояния в другое. Кроме работы расширения в данном примере осуществляется работа по увеличению поверхности объема породы. Эта работа затрачивается на преодоление сил поверхностного натяжения.
Таким образом, при подводе тепла к породе повышается ее температура и увеличивается объем. При этом подведенное тепло (как было отмечено выше) расходуется на увеличение внутренней энергии поводы U. совершение работы расширения А и другие виды работы А*. Согласно закону сохранения энергии можно записать
Q1-2=U1-2+A1-2+A*1-2, (1.14)
где Q1-2—тепло, сообщаемое выделенному объему породы при нагревании ее от состояния 1 до состояния 2, Дж. Выражение (1.14) в дифференциальной форме
dQ = dU + dA + dA* (1.15)
Уравнения (1.14) и (1.15) представляют собой математическое выражение первого закона термодинамики.
Так как внешняя работа, совершаемая при расширении породы, зависит от пути процесса, то аналогичную зависимость имеет и количество подведенного тепла.
Для единицы массы породы уравнение первого закона термодинамики имеет вид:
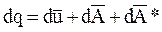 или
или 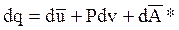 (1.16)
(1.16)
где q—количество тепла, подводимое к единице массы породы, Дж/кг; А и А*—соответственно работа расширения и другие виды работы, совершаемые единицей массы породы, Дж/кг.
Уравнение I-го закона термодинамики для изохорного процесса (V=const)
dQ = dU= Cv∙dT
то есть все подводимое тепло идет только на изменение внутренней энергии, учитывая что Cv=dqv /dT = (∂U/∂T)v – темп роста внутренней энергии.
Уравнение I-го закона термодинамики можно представить также в виде:
dq=du +d(P∙V)-V∙dP или dq= d(u+PV)- V∙dP= di - V∙dP
i – энтальпия или теплосодержание термодинамической системы.
7. Энтальпия и энтропия.
Энтальпией или теплосодержанием (I Дж) термодинамической системы называется сумма полной внутренней энергии (U) и произведения давления (Р) в системе на её объем (V).
I= U+P∙V
Уравнение I-го закона термодинамики для изобарного процесса
dq=di

Энтальпия, как и внутренняя энергия, является функцией двух независимых параметров состояния и не зависит от пути процесса, а только от начального и конечного состояния, следовательно, это экстенсивный параметр.
Начало отсчета энтальпии, как и внутренней энергии, в принципе не имеет значения, так как нас, прежде всего, интересует приращения этих величин.
В обратимых процессах при переходе термодинамической системы из состояния 1 в состояние 2 и обратно внутренняя энергия не изменяется, а может измениться только внешняя работа за счет подводимой энергии разность между подведенным количеством энергии в прямом процессе Q1 и отведенном при обратном процессе Q2 будет равна энергии затраченной на внешнюю работу. Отношение этой разности энергий к затраченной энергии называется термодинамическим коэффициентом полезного действия ήТ обратимого процесса.
ήТ = 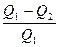
Так как подведенное или отведенное количество тепла пропорционально теплоемкости, массе и температуре системы, то термодинамический КПД обратимого процесса можно представить в виде
ήТ = 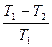
Т1 и Т2 температуры системы в состояниях 1 и 2. На основании этого можно записать
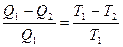 ;
; 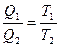 ;
; 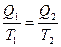 ;
; 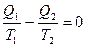 или в общем виде
или в общем виде 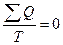
Так как при возвращении термодинамической системы в исходное состояние ее параметры (в том числе и Т) становятся равными первоначальным, а разность Q1-Q2≠0, то выражение 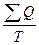 можно представить как интеграл по замкнутому контуру от функции
можно представить как интеграл по замкнутому контуру от функции 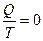 , то есть
, то есть 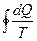 – интеграл Клаузиуса
– интеграл Клаузиуса
Подинтегральное выражение Клаузиус предложил заменить дифференциалом некоторой функции «S, Дж/0С», которая называется энтропией, то есть
ds = 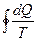 ;
; 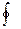 ds=0
ds=0
Это свидетельствует о том, что в обратимых процессах изменение энтропии системы равно 0, то есть энтропия не зависит от пути процесса, а определяется только параметрами начального и конечного состояний.
Энтропия – экстенсивный параметр.
Так как при нагревании систем dQ>0. А при охлаждении dQ<0, то при нагревании ds>0 – энтропия возрастает, при охлаждении ds<0 – энтропия убывает. Для адиабатических процессов dQ=0, поэтому ds=0 или s=const.
В связи с этим адиабатные процессы также называют изоэнтропическими.
8. Второй закон термодинамики.
I-ый закон термодинамики, являясь частным случаем закона сохранения и превращения энергии, характеризует процессы превращения энергии с количественной стороны. II –ой закон характеризует качественную сторону этих процессов. I-ый закон дает все необходимое для составления энергетического баланса процесса, но не дает указания о возможности его протекания. Однако не все процессы реально осуществимы. II-ой закон, как и I-ый сформулирован на основе опыта.
Любой реальный самопроизвольный процесс необратим. Трение необратимо превращается в тепло, следовательно, работа, совершаемая системой в термодинамическом процессе по абсолютной величине меньше работы подводимой к системе извне.
Из сказанного следует, что между преобразованием теплоты в работу и обратно существует глубокое различие. Закон, позволяющий указать направление теплового потока и устанавливающий максимально возможный предел превращения теплоты в работу в тепловых машинах, представляет собой новый закон, полученный из опыта. Это и есть второй закон термодинамики, имеющий общее значение для всех тепловых процессов. Второй закон термодинамики не ограничивается рамками техники, он применяется в физике, химии, биологии, астрономии и др.
Клаузиусом (1850): теплота не может сама переходить от более холодного тела к более нагретому.
Томсон (лорд Кельвин) (1851г): невозможно при помощи неодушевленного материального агента получить от какой либо массы вещества механическую работу путем охлаждения ее ниже температуры самого холодного из окружающих предметов.
Планк: невозможно построить периодически действующую машину, все действие которой сводилось бы к поднятию некоторого груза и охлаждению теплового источника (нельзя построить тепловой двигатель при наличии лишь одного источника тепла)
Вечный двигатель первого рода – количество производимой работы больше чем количество тепла подводимого к рабочему телу от внешнего источника.
Вечный двигатель второго рода – способен целиком превращать в работу всю теплоту, полученную от одного источника.
Изменение энтропии в необратимых процессах
Рассмотрим изолированную систему состоящую из двух тел (частей), находящихся при разных температурах Т1 и Т2 причем (Т1> Т2). Между этими частями будет происходить процесс теплообмена (от тела с Т1 к телу с Т2) от первого ко второму телу переходит количество тепла dQ. В соответствии с определением энтропии ds=dQ/T энтропия первого тела уменьшается на ds=-dQ/T1, а энтропия второго тела увеличится на ds=dQ/T2. Общее изменение энтропии всей системы будет
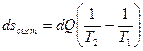 , так как Т1> Т2 то dsсист>0
, так как Т1> Т2 то dsсист>0
То есть в результате необратимого процесса энтропия системы возрастает. Для обратимого процесса ds=dQ/T=0 следует, что в изолированной системе при обратимом процессе энтропия остается постоянной.
Для любых процессов можно написать
dsсист≥0 или dsсист≥ 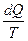
Это выражение представляет собой аналитическое выражение второго закона термодинамики [без внешнего воздействия процессы могут происходить только в том случае, когда их энтропия возрастает (необратимые процессы)или постоянна (обратимые процессы)].
Последнее выражение можно записать в виде
Т*dS≥dQ или для единичной массы Т*ds≥dq
В соответствии с первым законом термодинамики имеем
dq=dU+dA+dA* или dq=du+da+da*
dq=dU+P*dV+dA* или dq=du+p∙dv+da*