Модели атомов
- Кусочки материи. Демокрит полагал, что свойства того или иного вещества определяются формой, массой, и пр. характеристиками образующих его атомов. Так, скажем, у огня атомы остры, поэтому огонь способен обжигать, у твёрдых тел они шероховаты, поэтому накрепко сцепляются друг с другом, у воды — гладки, поэтому она способна течь. Даже душа человека, согласно Демокриту, состоит из атомов.[2]
- Модель атома Томсона (модель «Пудинг с изюмом»). Дж. Дж. Томсон предложил рассматривать атом как некоторое положительно заряженное тело с заключёнными внутри него электронами. Была окончательно опровергнута Резерфордом после проведённого им знаменитого опыта по рассеиванию альфа-частиц.
- Ранняя планетарная модель атома Нагаоки. В 1904 году японский физик Хантаро Нагаока предложил модель атома, построенную по аналогии с планетой Сатурн. В этой модели вокруг маленького положительного ядра по орбитам вращались электроны, объединённые в кольца. Модель оказалась ошибочной.
- Планетарная модель атома Бора-Резерфорда.
- >
 В 1911 году[3] Эрнест Резерфорд, проделав ряд экспериментов, пришёл к выводу, что атом представляет собой подобие планетной системы, в которой электроны движутся по орбитам вокруг расположенного в центре атома тяжёлого положительно заряженного ядра («модель атома Резерфорда»). Однако такое описание атома вошло в противоречие с классической электродинамикой. Дело в том, что, согласно классической электродинамике, электрон при движении с центростремительным ускорением должен излучать электромагнитные волны, а, следовательно, терять энергию. Расчёты показывали, что время, за которое электрон в таком атоме упадёт на ядро, совершенно ничтожно. Для объяснения стабильности атомов Нильсу Бору пришлось ввести постулаты, которые сводились к тому, что электрон в атоме, находясь в некоторых специальных энергетических состояниях, не излучает энергию («модель атома Бора-Резерфорда»). Постулаты Бора показали, что для описания атома классическая механика неприменима. Дальнейшее изучение излучения атома привело к созданию квантовой механики, которая позволила объяснить подавляющее большинство наблюдаемых фактов.
В 1911 году[3] Эрнест Резерфорд, проделав ряд экспериментов, пришёл к выводу, что атом представляет собой подобие планетной системы, в которой электроны движутся по орбитам вокруг расположенного в центре атома тяжёлого положительно заряженного ядра («модель атома Резерфорда»). Однако такое описание атома вошло в противоречие с классической электродинамикой. Дело в том, что, согласно классической электродинамике, электрон при движении с центростремительным ускорением должен излучать электромагнитные волны, а, следовательно, терять энергию. Расчёты показывали, что время, за которое электрон в таком атоме упадёт на ядро, совершенно ничтожно. Для объяснения стабильности атомов Нильсу Бору пришлось ввести постулаты, которые сводились к тому, что электрон в атоме, находясь в некоторых специальных энергетических состояниях, не излучает энергию («модель атома Бора-Резерфорда»). Постулаты Бора показали, что для описания атома классическая механика неприменима. Дальнейшее изучение излучения атома привело к созданию квантовой механики, которая позволила объяснить подавляющее большинство наблюдаемых фактов.
Достжения экспериментальной физики к концу XIX в. доказали неправомерность представлений о неделимости атома. Французский физик Беккерель в 1896 г. обнаружил самопроизвольное испускание урановыми рудами ранее неизвестного вида излучения, проникающего через вещества. Позднее в 1898 г. то же явление было обнаружено и основательно изучено французскими учеными П. Кюри и М. Склодовсткой-Кюри, которые объяснили наблюдаемое излучение естественной радиоактивностью. Они открыли в урановых рудах два новых и более мощных источника излучения, чем сам уран. Ими оказались радиоактивные элементы полоний и радий. Было найдено, что радий претерпевает многоступенчатый спонтанный распад, который заканчивается образованием стабильного свинца. Поскольку атомы свинца качественно отличаются от атомов радия, такое превращение элементов можно объяснить только тем, что атомы обоих элементов построены из одинаковых, более мелких, чем сами атомы, частиц. Это послужило основанием для глубокого теоретического и экспериментального изучения строения атома.
Первым основополагающим достижением в области изучения внутреннего строения вещества было создание модели атома английским физиком Резерфордом в 1911 г. По Резерфорду, атом состоит из ядра, окруженного электронной оболочкой.
1. в центре атома - положительно заряженное ядро:

| заряд ядра q = Z·e, где Z-порядковый номер элемента в таблице Менделеева, e =1.6·10-19 Кл - элементарный заряд; |

| размер ядра 10-13 см; |

| масса ядра фактически равна массе атома. |
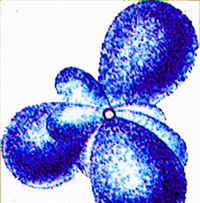
2. электроны движутся вокруг ядра по круговым и эллиптическим орбитам, как планеты вокруг Солнца:

| электроны удерживаются на орбите кулоновской силой притяжения к ядру, создающей центростремительное ускорение. |

| число электронов в атоме равно Z (порядковый номер элемента) |

| электроны движутся с большой скоростью, образуя электронную оболочку атома. |
Модель атома, предложенная Резерфордом, называется планетарной.
Датский физик теоретик Бор использовал представления Резерфорда и созданную немецким физиком Планком (1900 г.) квантовую теорию для разработки в 1913 г. теории водородоподобного атома и первой квантовой модели атома - модель атома Бора. Планетарная модель атома является внутренне противоречивой. Движущийся с ускорением заряд излучает электромагнитную волну. При этом энергия атома уменьшается: электрон должен упасть на ядро, а атом прекратить свое существование.
На самом деле атомы химических элементов представляют собой устойчивые структуры, существующие десятки тысяч лет без изменения. Поэтому модель атома Резерфорда была дополнена рядом положений.
В 1913 году Бор показал, что несовпадение с экспериментом выводов, основанных на модели Резерфорда, возникла потому, что поведение микрочастиц нельзя описывать теми же законами, что и макроскопических тел.
Бор предположил, что величины характеризующие микромир, должны квантоваться, т.е. они могут принимать только определенные дискретные значения.
Законы микромира - квантовые законы! Эти законы в начале ХХ века еще не были установлены наукой. Бор сформулировал их в виде трех постулатов. дополняющих (и "спасающих") атом Резерфорда.
Первый постулат:
Атомы имеют ряд стационарных состояний соответствующих определенным значениям энергий: Е1, Е2...En. Находясь в стационарном состоянии, атом энергии не излучает, несмотря на движение электронов.
Второй постулат:
В стационарном состоянии атома электроны движутся по стационарным орбитам
Третий постулат:
Излучение или поглощение энергии атомом происходит при переходе его из одного стационарного состояния в другое. При этом излучается или поглощается порция энергии (квант), равная разности энергий стационарных состояний, между которыми происходит переход.
Достоинства теории Бора
- Объяснила дискретность энергетических состояний водородоподобных атомов.
- Теория Бора подошла к объяснению внутриатомных процессов с принципиально новых позиций, стала первой полуквантовой теорией атома.
- Эвристическое значение теории Бора состоит в смелом предположении о существовании стационарных состояний и скачкообразных переходов между ними. Эти положения позднее были распространены и на другие микросистемы.
Недостатки теории Бора
- Не смогла объяснить интенсивность спектральных линий.
- Справедлива только для водородоподобных атомов и не работает для атомов, следующих за ним в таблице Менделеева.
- Теория Бора логически противоречива: не является ни классической, ни квантовой. В системе двух уравнений, лежащих в её основе, одно — уравнение движения электрона — классическое, другое — уравнение квантования орбит — квантовое.
Теория Бора являлась недостаточно последовательной и общей. Поэтому она в дальнейшем была заменена современной квантовой механикой, основанной на более общих и непротиворечивых исходных положениях. Сейчас известно, что постулаты Бора являются следствиями более общих квантовых законов. Но правила квантования типа широко используются и в наши дни как приближенные соотношения: их точность часто бывает очень высокой.
В 1916 г. модель атома Бора была усовершенствована немецким физиком Зоммерфельдом, который объединил квантовую теорию Планка и теорию относительности Эйнштейна (1905 г.), создав квантовую теорию атомных орбит, которые по Зоммерфельду, могут быть не только круговыми но и эллиптическими.
Следующий этап в становлении квантовой теории строения атома начался с теоретического обоснования французским ученым де Бройлем двойственной природы материальных частиц, в частности электрона. Распространив идею Эйнштейна о двойственной природе света на вещество, де Бройль постулировал (1924 г.), что поток электронов, наряду с корпускулярным характером обладает и волновыми свойствами. Согласно де Бройлю, с каждым микрообъектом связываются, с одной стороны, корпускулярные характеристики — энергия 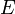 и импульс
и импульс  , а с другой стороны — волновые характеристики — частота и длина волны. Поскольку квантовая теория приписывает световым фотонам при фотоэффекте корпускулярное поведение, можно допустить, что электроны в атомах могут вести себя на своих "орбитах" подобно волнам. Де Бройль пришел к выводу, что с движением любого вида частиц можно "ассоциировать" распространение волны, если приписать частице с массой m и скоростью v длину волны l = h/mv. Экспериментальным подтверждением волновых свойств частиц явилось открытое в 1927 К.Дэвиссоном (1881-1958) и Л.Джермером (1896-1971) явление дифракции электронов. Угловое распределение электронов при отражении пучка электронов от поверхности кристалла можно объяснить лишь на основе волновых представлений, причем наблюдалось согласие с постулированным де Бройлем соотношением между длиной волны и скоростью. Этим объясняется двойственная природа электрона, всех микрочастиц. Согласно принципу неопределённостей у частицы не могут быть одновременно точно измерены положение и скорость (импульс). Соотношения неопределённостей Гейзенберга являются теоретическим пределом точности одновременных измерений двух величин (скорости и положения частицы в пространстве).
, а с другой стороны — волновые характеристики — частота и длина волны. Поскольку квантовая теория приписывает световым фотонам при фотоэффекте корпускулярное поведение, можно допустить, что электроны в атомах могут вести себя на своих "орбитах" подобно волнам. Де Бройль пришел к выводу, что с движением любого вида частиц можно "ассоциировать" распространение волны, если приписать частице с массой m и скоростью v длину волны l = h/mv. Экспериментальным подтверждением волновых свойств частиц явилось открытое в 1927 К.Дэвиссоном (1881-1958) и Л.Джермером (1896-1971) явление дифракции электронов. Угловое распределение электронов при отражении пучка электронов от поверхности кристалла можно объяснить лишь на основе волновых представлений, причем наблюдалось согласие с постулированным де Бройлем соотношением между длиной волны и скоростью. Этим объясняется двойственная природа электрона, всех микрочастиц. Согласно принципу неопределённостей у частицы не могут быть одновременно точно измерены положение и скорость (импульс). Соотношения неопределённостей Гейзенберга являются теоретическим пределом точности одновременных измерений двух величин (скорости и положения частицы в пространстве).
Исходя из учения о корпускулярно-волновой природе частиц вещества, австрийский физик Шрёдингер и ряд других ученых разработали теорию движения микрочастиц - волновую механику, которая привела к созданию квантово-механической модели атома.
Волновая механика Шрёдингера и матричная механика, созданная в то время немецким физиком Гейзенбергом (Хайзенбергом), явились двумя равноценными формами представления квантовой механики. Однако ни одна из созданных моделей полностью не воспроизводит реальную действительность, хотя и является полезной для решения определенных научных задач. Модель атома Бора более десяти лет служила инструментом для трактовки химической связи. Тем не менее представление о том, что электроны движутся по определенным орбитам вокруг ядра, недостаточно точно соответствует реальному их поведению в атоме. Такое представление о способе существования электронов в атоме следует признать упрощенным, заимствованным из теории механики движения твердых макротел, поэтому оно непригодно для объяснения возникновения химической связи между атомами.
Квантово-механическая модель атома
Современная модель атома является развитием планетарной модели. Согласно этой модели, ядро атома состоит из положительно заряженных протонов и не имеющих заряда нейтронов и окружено отрицательно заряженными электронами. Однако представления квантовой механики не позволяют считать, что электроны движутся вокруг ядра по сколько-нибудь определённым траекториям (неопределённость координаты электрона в атоме может быть сравнима с размерами самого атома).
Квантовые числа (К.ч.)
Набор К. ч., исчерпывающе определяющий состояние квантовой системы, называется полным. Совокупность состояний, отвечающих всем возможным значениям К. ч. из полного набора, образует полную систему состояний. Состояние электрона в атоме определяется четырьмя К. ч. соответственно четырём степеням свободы электрона (3 степени свободы связаны с тремя координатами, определяющими пространственное положение электрона, а четвёртая, внутренняя, степень свободы — с его спином). Для атома водорода и водородоподобных атомов эти К. ч., образующие полный набор, следующие.
Главное К. ч. n = 1, 2, 3,... определяет уровни энергии электрона.
Азимутальное (или орбитальное) К. ч. l = 0, 1, 2,..., n — 1 задаёт спектр возможных значений квадрата орбитального момента количества движения электрона: 
Магнитное К. ч. ml характеризует возможные значения проекции Mlz орбитального момента Ml на некоторое, произвольно выбранное, направление (принимаемое за ось z): 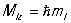 l до + l (всего 2 l + 1 значений).
l до + l (всего 2 l + 1 значений).
Магнитное спиновое К, ч., или просто спиновое К. ч., ms характеризует возможные значения проекции спина электрона и может принимать 2 значения:
ms = ± 1/2.
Задание состояния электрона с помощью К. ч. n, l, ml и ms не учитывает так называемой тонкой структуры энергетических уровней — расщепления уровней с данным n (при n ≥ 2) в результате влияния спина на орбитальное движение электрона.
При́нцип Па́ули (принцип запрета) — один из фундаментальных принципов квантовой механики, согласно которому два и более тождественных фермиона (частиц с полуцелым спином) не могут одновременно находиться в одном квантовом состоянии.
Принцип Паули можно сформулировать следующим образом: в пределах одной квантовой системы в данном квантовом состоянии может находиться только одна частица, состояние другой должно отличаться хотя бы одним квантовым числом
Правило Хунда определяет порядок заполнения орбиталей определённого подслоя и формулируется следующим образом: модуль суммарного значения спинового квантового числа электронов данного подслоя должен быть максимальным. Сформулировано Фридрихом Хундом в 1925 году.
Это означает, что в каждой из орбиталей подслоя заполняется сначала один электрон, а только после исчерпания незаполненных орбиталей на эту орбиталь добавляется второй электрон. При этом на одной орбитали находятся два электрона с полуцелыми спинами противоположного знака, которые спариваются (образуют двухэлектронное облако) и, в результате, суммарный спин орбитали становится равным нулю.
Химические свойства атомов определяются конфигурацией электронной оболочки и описываются квантовой механикой. Положение атома в таблице Менделеева определяется электрическим зарядом его ядра (то есть количеством протонов), в то время как количество нейтронов принципиально не влияет на химические свойства; при этом нейтронов в ядре, как правило, больше, чем протонов (см.: атомное ядро). Если атом находится в нейтральном состоянии, то количество электронов в нём равно количеству протонов. Основная масса атома сосредоточена в ядре, а массовая доля электронов в общей массе атома незначительна (несколько сотых процента массы ядра).
Энергия ионизации
Энергия (потенциал) ионизации атома Ei - минимальная энергия, необходимая для удаления электрона из атома на бесконечность
При движении слева направо по периоду энергия ионизации, вообще говоря, постепенно увеличивается, при увеличении порядкового номера в пределах группы - уменьшается. Минимальные первые потенциалы ионизации имеют щелочные металлы, максимальные - благородные газы.
Для одного и того же атома вторая, третья и последующие энергии ионизации всегда увеличиваются, так как электрон приходится отрывать от положительно заряженного иона. Например, для атома лития первая, вторая и третья энергии ионизации равны 520,3, 7298,1 и 11814,9 кДж/моль, соответственно.
Последовательность отрыва электронов - обычна обратная последовательности заселения орбиталей электронами в соответствии с принципом минимума энергии. Однако элементы, у которых заселяются d -орбитали, являются исключениями - в первую очередь они теряют не d -, а s -электроны.
Сродство к электрону
Сродство атома к электрону A e - способность атомов присоединять добавочный электрон и превращаться в отрицательный ион. Мерой сродства к электрону служит энергия, выделяющая или поглощающаяся при этом. Сродство к электрону равно энергии ионизации отрицательного иона.
Электроотрицательность
Электротрицательность характеризует способность атома химического элемента смещать в свою сторону электронное облако при образовании химической связи (в сторону элемента с более высокой электроотрицательностью).