Тема 12: Теория электролитической диссоциации. Диссоциация воды. Произведение растворимости
После изучения темы студент должен знать:
- сущность электролитической диссоциации;
- вещества-электролиты; сильные и слабые электролиты; степень диссоциации;
- особенность растворов сильных электролитов, кажущаяся концентрация, кажущаяся степень диссоциации;
- сущность диссоциации слабых электролитов; закон разбавления Оствальда, взаимосвязь константы диссоциации и степени диссоциации;
- свойства воды как электролита, водородный показатель; определение кислот, солей, оснований с точки зрения электролитической диссоциации.
- условия выпадения осадка
Уметь:
1. записывать схемы диссоциации электролитов;
2. записывать выражения константы диссоциации для электролитов; пользоваться константой для определения силы электролитов;
3. проводить расчеты с использованием формул степени диссоциации и закона разбавления;
4. проводить расчеты рН;
5. практически определять рН растворов с использованием индикаторов.
6. пользоваться значением произведения растворимости для определения образования осадков или их растворения
Вопросы для обсуждения
- Объяснить, почему диссоциируют электролиты в растворе?
- Что такое «сила электролитов», какие количественные показатели ее характеризуют? Записать формулу степени диссоциации. Объяснить на примере (что значит степень диссоциации 10%)
- Какая связь между степенью диссоциации и ее константой?
- Как диссоциируют кислоты, основания, соли средние, кислые, основные на примере, записать уравнения диссоциации и привести выражения констант диссоциации.
- Что такое «ионное произведение воды», водородный показатель? Для чего он используется?
- Дать определение понятию «Произведение растворимости», Как применить его для объяснения выпадения осадка?
Формулы, которые следует выучить наизусть
.

| Степень диссоциации a электролита – это доля его молекул, подвергшихся диссоциации, т.е. отношение числа молекул, распавшихся на ионы, к общему числу растворенных молекул электролита: |

| Константа химического равновесия процесса диссоциации называется константой диссоциации
Для реакции 
|
Кд = СМ × a2, откуда
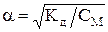
| Связь константы диссоциации со степенью диссоциации |
| Кводы= [Н+]×[ОН–]. | Ионное произведение воды |
| [Н+] = [ОН–] = 10-7 моль/л. | Нейтральная среда |
| pН = -lg[Н+]. | Водородный показатель рН является количественной характеристикой среды раствора и вычисляется через отрицательный десятичный логарифм от концентрации ионов Н+: |
| рОН = -lg [ОН–]. | Гидроксильный показатель |
| рН + рОН = 14 при 22 °С | Суммарное значение показателей в разбавленном водном растворе |

| Произведение растворимости для нерастворимого вещества

|
 >ПР >ПР
| Условием образования осадка является превышение произведения концентраций ионов малорастворимого электролита над его произведением растворимости. Растворение же осадка малорастворимого электролита происходит при условии, что произведение концентраций его ионов меньше значения произведения растворимости. |
Примеры решения задач
Пример 1. Найти степень диссоциации и концентрацию ионов Н+ сероводородной кислоты по первой ступени в 0,1М растворе, если константа диссоциации для этой ступени равна 1,1×10-7.
Решение:
Сероводородная кислота очень слабая, диссоциирует по уравнению
H2S = Н+ + HS–.
Используя упрощенное выражение закона разбавления Оствальда, вычисляем степень диссоциации:
 ;
;
a = 1,05×10-3×100 = 0,105 %.
Концентрация ионов [Н+] = См × a = 0,1×1,05×10–3 = 1,05×10–4 моль/л.
Пример 2.
Вычислить произведение растворимости фосфата серебра, если его растворимость равна 0,0065 г/л.
Решение:
Находим концентрацию Ag3PO4 (т.е. сколько моль растворилось). Молярная масса Ag3PO4 равна 418,6 г/моль.
С = 6,5·10-3 / 418,6 = 1,6·10-5 моль/л.
В растворе соли диссоциируют. При диссоциации Ag3PO4 образуется три иона Ag+ и один ион РO43– :
АgзРO4 = 3 Ag+ + PO43–,
поэтому [PO43–] равна растворимости Ag3PO4 , а концентрация иона Ag+ в 3 раза больше, т.е.
[РO43–] = 1,6·10-5 моль/л; [Ag+]=3·1,6·10-5 =4,8 · 10 -5 моль/л.
Произведение растворимости Ag3PО4:
 = [Ag+]3 · [ PO43–] = (4,8·10-5)3 · 1,6·10-5=1,77·10 - 18.
= [Ag+]3 · [ PO43–] = (4,8·10-5)3 · 1,6·10-5=1,77·10 - 18.
Исходя из значений ПР, можно вычислять растворимость малорастворимых электролитов в воде и растворах, содержащих другие электролиты.
Дополнительно решение типовых задач:
См. [5] глава VII. Растворы электролитов.
1. Слабые электролиты: примеры 1, 2, 3, 4, 5;
2. Ионное произведение воды: примеры 1, 2, 3.
[3] Стр. 145 -147: примеры № 1-5.
Задачи для самостоятельного решения
[3] Стр.131-134. Стр. 138: № 1,3,4, 5. 138-141, Стр. 145 № 4, 7,8,10
[5], 538, 539,568,570
Химический эксперимент
[3] Стр. 136-137 опыт 2а, б; 4, 5а; 5б – демонстрационно; 6а, б (только с KClO3) стр. 143: 5(демонстр.); 8(теор); 9(теор).
Пример тестовых заданий
1. Анион HS- образуется при электролитической диссоциации, формула которого
1) CuS; 2) H2SO3; 3) Na2S; 4) H2S.
2. Наибольшее число ионов Cl- находится в водном растворе:
1) HClO4; 2) NH4Cl; 3) KClO3; 4) C2H5Cl.
3. Наибольшее химическое количество ионов PO43- образуется при диссоциации 0,2 моль
1) NaH2PO4; 2) NaHPO4; 3) H3PO4; 4) Na3PO4.
4. В качестве анионов только гидроксид-ионы образуются при диссоциации:
1) KOH; 2) Al(OH)3; 3) CuOHCl; 4) KHCO3.
5. В растворе Al2(SO4)3 содержится 0,3 моль ионов SO42-. Химическое количество (моль) ионов Al3+ в этом же растворе составляет:
1) 0,2; 2) 0,3; 3) 0,1; 4) 0,5.
6. Степень диссоциации уксусной кислоты увеличивается если:
а) нагреть раствор;
б) разбавить раствор водой;
в) добавить в раствор ацетат натрия;
г)добавить в раствор немного щелочи;
д) добавить в раствор HCl.
1) а, б, д; 2) а, в; 3) б, г; 4) в, б, д.
7. На каждые 20 не распавшихся молекул кислоты НХ приходится 5 ионов Н+ и 5 ионов Х-. Укажите степень диссоциации кислоты.
1) 0,05; 2) 0,10; 3) 0,15; 4)0,20.
8. Вычислите рН раствора СН3СООН если степень диссоциации составляет 1%:
1) 0,77; 2)2,77; 3) 3,77; 4) 4,77.
9. Водные растворы каких веществ имеют рН > 7?
1) NaCl; 2) NaOH; 3) HCl;4) NH3×H2O.
10. рН раствора это
1) –lg[H+]
2) +lg[H+]
3) –lg[OH-]
4) +lg[OH-]
11. Произведение растворимости – это
1. произведение концентраций (активностей) ионов в насыщенном растворе
2. произведение концентраций (активностей) ионов в разбавленном растворе
3. произведение концентраций (активностей) ионов в концентрированном растворе
4. произведение концентраций (активностей) ионов в растворе любой концентрации
12. Осадок выпадает, если
1. произведение ионов в растворе больше произведения растворимости
2. произведение ионов в растворе меньше произведения растворимости
3. произведение ионов в растворе равно произведению растворимости
4. коэффициент растворимости равен произведению растворимости
13. В каком направлении будет смещено равновесие реакции
AgI (к) + NaCl = AgCl + Na I (к)
1 в прямом
2. в обратном
14. Растворимость СаСО3 при 35о С равна 6,9 10 -5 моль/л. Вычислить произведение растворимости соли.
Ответ__________
15. Чему равна концентрация гидроксид-ионов рН которого равна 8
Ответ________