Министерство образования и науки РФ
Тольяттинский государственный университет
Кафедра «Водоснабжение и водоотведение»
Контрольная работа
По дисциплине: Гидравлика и теплотехника
Вариант 21
Студентка: Шпрингер Д.С
Группа: ЗОСб-301
Преподаватель: Козина Л.Н.
Тольятти 2011
Исследование адиабатного процесса.
Адиабатным называется процесс, который протекает без теплообмена с окружающей средой (dq = 0).
В обратимых адиабатных процессах энтропия не изменяется (ds = 0,
s = const), в необратимых - энтропия увеличивается (ds > 0).
Уравнение обратимого адиабатного процесса имеет вид
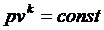 , ,
| (4.43) |
где k – показатель адиабаты.
Для идеального газа
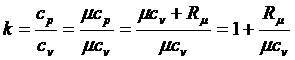 . .
| (4.44) |
Для одноатомного идеального газа показатель адиабаты не зависит от температуры:
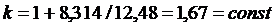 . .
|
Для двух-, трех- и многоатомных идеальных газов k = f (T), т.к. теплоемкость mcv = f (T). С увеличением температуры показатель адиабаты убывает.
Если принять теплоемкость постоянной в соответствии молекулярно-кинетической теорией газов, то для двухатомных газов
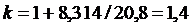 , ,
|
для трех- и многоатомных газов:
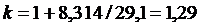 . .
|
Расчет адиабатных процессов двух-, трех- и многоатомных газов при значениях показателя адиабаты 1,4; 1,29 является приближенным, т.к. не учитывает зависимость теплоемкости от температуры.
Совместное решение (4.43) с уравнением состояния идеального газа
pv = RT дает следующие связи параметров:
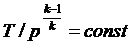 , ,
| (4.45) |
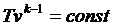 . .
| (4.46) |
Для адиабатного процесса 1-2, в котором параметры изменяются от p1, v1, T1 до p2, v2, T2, на основании уравнений (4.43), (4.45), (4.46) можно получить следующие соотношения между параметрами:
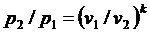 , ,
| (4.47) |
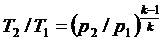 , ,
| (4.48) |
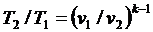 . .
| (4.49) |
Совместное решение уравнений
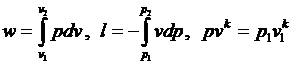
позволяет получить расчетные формулы для работы адиабатного процесса
1-2:
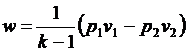 , ,
| (4.50) |
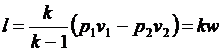 . .
| (4.51) |
С учетом уравнения состояния pv = RT, а также соотношения (4.48) формулу (4.50) можно представить следующим образом:
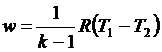 , ,
| (4.52) |
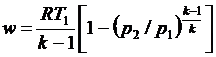 . .
| (4.53) |
По формулам (4.46) - (4.53) производят расчеты адиабатных процессов одноатомного идеального газа и приближенные расчеты двух-, трех- и многоатомных газов при значениях k = 1,4, k = 1,29.
Расчет адиабатных процессов с учетом зависимости k = f (T) по вышеприведенным формулам прост, если известны температуры T1 и T2. В противном случае используется метод последовательных приближений, что значительно усложняет расчет.
Более простым является табличный метод расчета адиабатного процесса идеального газа с учетом зависимости теплоемкости от температуры. В основе расчета лежат следующие уравнения:
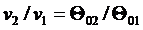 , ,
| (4.54) |
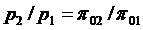 , ,
| (4.55) |
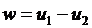 , ,
| (4.56) |
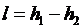 . .
| (4.57) |
Здесь 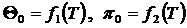 - безразмерные величины, приведенные в таблицах термодинамических свойств газов [7], h, u - табличные значения параметров.
- безразмерные величины, приведенные в таблицах термодинамических свойств газов [7], h, u - табличные значения параметров.
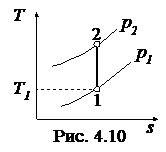
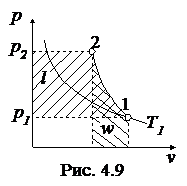 |
Обратимый адиабатный процесссжатия идеального газа, построенный по исходным параметрам p1, T1, p2 в p - v- и T - s- диаграммах, представлен на рис.4.9 и 4.10.
В p - v- диаграмме адиабата - несимметричная гипербола располагается круче изотермы, в T - s- диаграмме – изоэнтропа (s = const, q = 0).
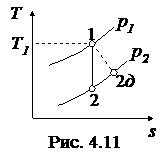 | 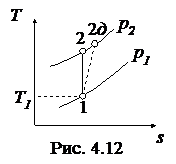 | ||
Необратимые адиабатные процессы (1-2 д), протекающие с увеличением энтропии, показаны на рис. 4.11, 4.12.
Работа необратимого адиабатного расширения (рис.4.11) равна
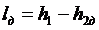 , ,
|
и она меньше работы обратимого процесса, вычисляемого по формуле
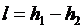 . .
|
Напротив, работа необратимого адиабатного сжатия (рис. 4.12), равная
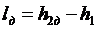 , ,
|
больше работы обратимого процесса
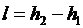 . .
|
Дано: p1 = 50 бар, t1 = 480 0C, t2 = 100 0C.
Определить: w, l.
Расчет процесса с помощью таблиц
1. Определяют начальное состояние. При p1 = 50 бар температура насыщения ts = 263,9 0С. Поскольку t1 > ts, то рабочее тело является перегретым паром. Из табл. III находят
h1 = 3367,2 кДж/кг, v1 = 0,06644 м3/кг, s1 = 6,9158 кДж/кг.К.
Рассчитывают внутреннюю энергию:
u1 = h1 - p1.v1 = 3387,2 - 50.102.0,06644 = 3055 кДж/кг.
2. Определяют конечное состояние путем сравнения энтропии
s2 = s1 = 6,9158 кДж/(кг.К) с s¢ и s¢¢, взятыми из табл. I по температуре
t2 = 100 0С. Поскольку s¢ < s < s¢¢, то конечное состояние рабочего тела - мокрый пар. Рассчитывают степень сухости и параметры мокрого пара:
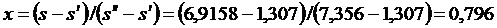
|
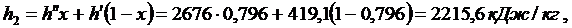
|
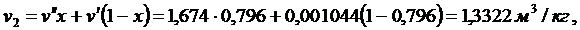
|
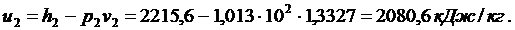
|
3. Рассчитывают работу адиабатного процесса:
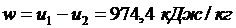 , ,
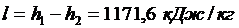
|
4.
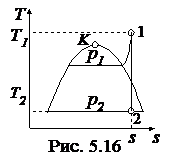 | |||||
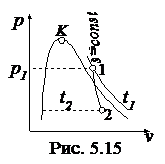 | |||||
 |
Представляют процесс в диаграммах p - v, T - s, h - s (рис. 5.15-5.17)