Свойства щелочных металлов.

 →H2 tº МеН
→H2 tº МеН
 →Cl2 tº МеCl
→Cl2 tº МеCl
 →N2 tº Ме3N (Li3 N на воздухе )
→N2 tº Ме3N (Li3 N на воздухе )
 Ме → →S t º Ме2S
Ме → →S t º Ме2S
 →O2 tº Li2O; Na2O2; КО2
→O2 tº Li2O; Na2O2; КО2
 →P tº Ме3P
→P tº Ме3P
 →C tº Ме2C2 (Li2C2, но Na4C)
→C tº Ме2C2 (Li2C2, но Na4C)
 →H2O МеOH + H2
→H2O МеOH + H2
 →HCl МеCl + H2
→HCl МеCl + H2
 →HNO3 разб. МеNO3 + NH4NO3 + H2О
→HNO3 разб. МеNO3 + NH4NO3 + H2О
 →HNO3 конц. МеNO3 + N2O + H2О
→HNO3 конц. МеNO3 + N2O + H2О
 →H2SO4 конц. Ме2SO4+ Н2S + H2О
→H2SO4 конц. Ме2SO4+ Н2S + H2О
 →соли Me1A n(распл.) tº МеAn + Ме1
→соли Me1A n(распл.) tº МеAn + Ме1
 →R-Hal tº R - R + Ме-Hal (Hal - галоген)
→R-Hal tº R - R + Ме-Hal (Hal - галоген)
 → R-OH R-OМе + H2
→ R-OH R-OМе + H2
Производные:
1) NaH + H2O = NaOH + H2↑;
2) Na3N + 3H2O = 3NaOH + NH3 ↑;
t º
3) Na2S + 2H2O = 3NaOH + H2S↑;
4) Na2O2 + 2H2O → 2NaOH + H2O2 ;
5) Na3P + 3H2O = 3NaOH + PH3 ↑;
6) Li2C2 + 2H2O = 2LiOH + C2H2↑;
Свойства щелочноземельных металлов.
 |
 →H2 tº МеН2
→H2 tº МеН2
→Cl2 t º МеCl2
 →N2 tº Ме3N2
→N2 tº Ме3N2

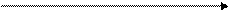 Ме → →S tº МеS
Ме → →S tº МеS
 →O2 tº МеO;
→O2 tº МеO;
 →P tº Ме3P2
→P tº Ме3P2
 →C tº МеC2 (Ве2C)
→C tº МеC2 (Ве2C)
 →H2O Ме(OH)2 + H2 (Mg при tº)
→H2O Ме(OH)2 + H2 (Mg при tº)
 →HCl МеCl2 + H2
→HCl МеCl2 + H2
 →HNO3 разб. Ме(NO3)2 + NH4NO3 + H2О
→HNO3 разб. Ме(NO3)2 + NH4NO3 + H2О
→HNO3 конц. Ме(NO3)2 + N2O + H2О
 →H2SO4 конц. Ме2SO4+ Н2S + H2О
→H2SO4 конц. Ме2SO4+ Н2S + H2О
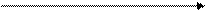
 → КOH К2[Be(OH)4] + H2
→ КOH К2[Be(OH)4] + H2
Производные:
1. Ме3N2 + 6H2O = 3Ме(OH)2 +2 NH3 ↑;
2. Ме3P2 + 6H2O = 3Ме(OH)2 + 2 PH3 ↑;
3. Ве2C + 4H2O = 2Ве(OH)2 + CH4↑;
4. МеC2 + 2H2O = Ме(OH)2 + C2H2;↑
Свойства бора.

 →H2 не реагирует
→H2 не реагирует
(образует бороводороды - бораны в реакции НСl c Mg3B2)
 →Cl2 tº ВCl3
→Cl2 tº ВCl3
 →Мg tº Mg3B2 (бориды)
→Мg tº Mg3B2 (бориды)
 В → → N2 1100 t° BN (боразон)
В → → N2 1100 t° BN (боразон)
 →O2 700 t° B2O3
→O2 700 t° B2O3
 → C t° В4C3
→ C t° В4C3
 → H2O не реагирует
→ H2O не реагирует
 →3HNO3 конц. H3BO3 + 3NO2
→3HNO3 конц. H3BO3 + 3NO2
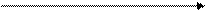 →H2SO4 конц. 2H3BO3 + 3SO2
→H2SO4 конц. 2H3BO3 + 3SO2

 B2O3 → → H2O H3BO3 (ортоборная кислота)
B2O3 → → H2O H3BO3 (ортоборная кислота)
 2 HBO2 (метаборная кислота) B2O3 + H2O
2 HBO2 (метаборная кислота) B2O3 + H2O
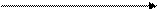 2BN + 3H2O B2O3 + 2NH3
2BN + 3H2O B2O3 + 2NH3

 → 100 t° HBO2 + H2O
→ 100 t° HBO2 + H2O
 B(OH)3 → 2 HBO2 B2O3 + H2O
B(OH)3 → 2 HBO2 B2O3 + H2O
 (или H3BO3) → NaOH Na2В4O7 (тетраборат натрия)
(или H3BO3) → NaOH Na2В4O7 (тетраборат натрия)
Производные:
1. 2BN + 3H2O = B2O3 + 2NH3 ↑;
t º
2. H3BO3 = HBO2 + H2O;
t º
3. 2HBO2 = B2O3 + H2O;
4. mНСl + nMg3B2 = 3nMgCl2 + 2ВnНm ;
В результате данной реакции образуются бороводороды - бораны сложная смесь:
В2Н6 (газ); В4Н10; В5Н9; В5Н11; В6Н10 (жидкости); В10Н14 (тв.). Главным продуктом взаимодействия является тетраборан В4Н10.
t
5. В4Н10 = В2Н6 + В2Н4;
6. В2Н6 + 6H2O = 2Н3 ВO3 + 6H2;
7. Na2В4O7 + H2 SO4 + 5H2O = Na2 SO4 + 4Н3 ВO3;
Свойства алюминия.

 →H2 не реагирует
→H2 не реагирует
 →Cl2 AlCl3
→Cl2 AlCl3
 →N2 tº AlN
→N2 tº AlN
 Al → →S tº Al2S3
Al → →S tº Al2S3
 →O2 Al2O3
→O2 Al2O3
 →I2 tº kat. H2O Al I3
→I2 tº kat. H2O Al I3
 →C 1200t°С Al4C3
→C 1200t°С Al4C3
 →H2O Al(OH)3 + H2 ↑ (из амальгамы)
→H2O Al(OH)3 + H2 ↑ (из амальгамы)
 →HCl AlCl3 + H2 ↑
→HCl AlCl3 + H2 ↑
 →HNO3 разб. Al(NO3)3 + NH4NO3 + H2О
→HNO3 разб. Al(NO3)3 + NH4NO3 + H2О
 →HNO3 конц. не реагирует (пассивируется)
→HNO3 конц. не реагирует (пассивируется)
 →H2SO4 конц. не реагирует (пассивируется)
→H2SO4 конц. не реагирует (пассивируется)
 →NaOH (распл.) tº NaAlO2 + H2 ↑
→NaOH (распл.) tº NaAlO2 + H2 ↑
 → NaOH (конц.) tº Na3AlO3 + H2 ↑
→ NaOH (конц.) tº Na3AlO3 + H2 ↑
 → 2NaOH (р-р.) + 10H2O 2Na[Al(OH)4 (H2O)2 ] + 3H2 ↑
→ 2NaOH (р-р.) + 10H2O 2Na[Al(OH)4 (H2O)2 ] + 3H2 ↑
 → Fe2O3 tº (алюмотермия) Fe + Al2O3
→ Fe2O3 tº (алюмотермия) Fe + Al2O3
 → HCl AlCl3
→ HCl AlCl3
 →электролиз Al
→электролиз Al
 Al2O3 → → Na2CO3 tº NaAlO2 + CO2 ↑
Al2O3 → → Na2CO3 tº NaAlO2 + CO2 ↑
 →NaOH (распл.) tº NaAlO2 + H2 О↑
→NaOH (распл.) tº NaAlO2 + H2 О↑
 → 2NaOH (р-р.) + 7H2O 2 Na[Al(OH)4 (H2O)2]
→ 2NaOH (р-р.) + 7H2O 2 Na[Al(OH)4 (H2O)2]

 → HCl AlCl3
→ HCl AlCl3
 → tº Al2O3
→ tº Al2O3
 Al(OH)3 → → NaOH (р-р. разб..) + 2H2 О Na[Al(OH)4 (H2O)2]
Al(OH)3 → → NaOH (р-р. разб..) + 2H2 О Na[Al(OH)4 (H2O)2]
 →NaOH (распл.) tº Na3AlO3 или NaAlO2
→NaOH (распл.) tº Na3AlO3 или NaAlO2
 → 3NaOH (р-р. концентр.) Na3[Al(OH)6]
→ 3NaOH (р-р. концентр.) Na3[Al(OH)6]
Свойства углерода.

 →H2 (Pt t° р) CH4 (CxHy)
→H2 (Pt t° р) CH4 (CxHy)
 → S t ° CS2
→ S t ° CS2
 →Мe t° карбиды
→Мe t° карбиды
 С → → Si t° SiC
С → → Si t° SiC
 →O2 t° CO2
→O2 t° CO2
 → H2O t° H2 + CO
→ H2O t° H2 + CO
 → оксиды (Э2 On) t° Э + CO
→ оксиды (Э2 On) t° Э + CO


 СO2 → → H2O H2СO3 (частично)
СO2 → → H2O H2СO3 (частично)
 → Mg t° MgO + CO
→ Mg t° MgO + CO
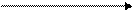 → C t° 2CO
→ C t° 2CO
 → 2NaOH Na2CO3 + H2O
→ 2NaOH Na2CO3 + H2O

 СO → → O2, t° СO2 ↑
СO → → O2, t° СO2 ↑
 → Cl2 (свет), t° СОCl2
→ Cl2 (свет), t° СОCl2
 → H2 (Ni), t° CH4 + СO2 ↑
→ H2 (Ni), t° CH4 + СO2 ↑
 → H2 (ZnO), t° CH3OH
→ H2 (ZnO), t° CH3OH
 → NaOH 200°C HCOONa
→ NaOH 200°C HCOONa
 → CuO, t° Cu + CO2
→ CuO, t° Cu + CO2
Карбиды.
Be2C + 4H2O = 2Be(OH)2 + CH4 ↑;
Al4C3 + 12H2O = 4Al(OH)3 + 3CH4 ↑;
CaC2 + 2H2O = Ca(OH)2 + C2H2 ↑;
Получение СO2
t º
С + О2 = СO2↑;
t º
СaCO3 → CaO + СO2↑;
СaCO3 + 2HCl → CaCl2 + СO2 ↑ + H2O;
Получение СO
t º
СO2 + C = 2CO;
t º
C + H2O = CO + H2;
t º, H2SO4 конц.
HCOOH CO + H2O;

Свойства кремния.

 →H2 не идет
→H2 не идет
 → S t ° SiS2
→ S t ° SiS2
 →Мe t° Me2Si
→Мe t° Me2Si
 Si → → C t° SiC
Si → → C t° SiC
 →O2 t º 600°С SiO2
→O2 t º 600°С SiO2
 → KOH K2SiO3 + H2
→ KOH K2SiO3 + H2
 → N2 t° Si3N4
→ N2 t° Si3N4
 → F2 SiF4
→ F2 SiF4

 SiO2 → → HF SiF4 ↑ + H2O
SiO2 → → HF SiF4 ↑ + H2O
 → Mg t° MgO + Si или MgO + Mg2Si
→ Mg t° MgO + Si или MgO + Mg2Si
 → Na2СO3 t°сплав Na2SiO3 + CO2 ↑
→ Na2СO3 t°сплав Na2SiO3 + CO2 ↑
 → NaOH t° сплав Na2SiO3 + H2O ↑
→ NaOH t° сплав Na2SiO3 + H2O ↑
Получение Si
t º
SiO2 + 2C = 2CO + Si;
t º
SiO2 + Mg = 2MgO + Si;
Свойства N2.


 →H2 t ° Pt NH3
→H2 t ° Pt NH3
 N2 → → Si t ° Si3N4
N2 → → Si t ° Si3N4
 →Мe t° нитриды Мe3N2
→Мe t° нитриды Мe3N2

 →O2 1500 t°C NO
→O2 1500 t°C NO
Свойства NH3.

 → O2 Pt NO + H2O
→ O2 Pt NO + H2O
 NH3 → → O2 t ° N2 + H2O
NH3 → → O2 t ° N2 + H2O
 → CuO t° Cu + H2O + N2
→ CuO t° Cu + H2O + N2
 → Cl2 N2 + HCl
→ Cl2 N2 + HCl
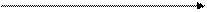 → H2O NH3 · H2O
→ H2O NH3 · H2O
 → HCl NH4 Cl
→ HCl NH4 Cl
Свойства NO2.

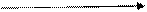 → O2 + H2O HNO3
→ O2 + H2O HNO3
 NO2 → → H2O HNO2 + HNO3
NO2 → → H2O HNO2 + HNO3
 → H2O t° HNO3 + NO
→ H2O t° HNO3 + NO
 → C CO2 + NO
→ C CO2 + NO
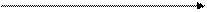 → SO2 SO3 +· NO
→ SO2 SO3 +· NO
 → S SO3 +· NO
→ S SO3 +· NO
 → O3 N2O5 + O2
→ O3 N2O5 + O2
 → KOH KNO3 + KNO2 + H2O
→ KOH KNO3 + KNO2 + H2O
→ KOH + O2 KNO3 + H2O

 → NO + H2O HNO2
→ NO + H2O HNO2
Получение N2
1. Из воздуха.
t º
2. 4NH3 + 3O2 = 2N2 ↑ + 6 H2O;
t º
3. NH4 NO2 = N2 ↑ + 2 H2O;
Получение NH3
t º 500-600°C, 1000атм
 1. N2 + 3H2 2NH3 ;
1. N2 + 3H2 2NH3 ;
t º
2. 2NH4 Cl + Ca(OH)2 = 2NH3 ↑ + 2 H2O + CaCl2;
Получение NO2
1. 2NO + O2 = 2NO2 ↑;
2. 4HNO3 конц. + Cu = 2NO2 ↑ + Cu(NO3)2 + 2 H2O;
3. Разложение некоторых нитратов и азотной кислоты.
t º, свет
 4HNO3 4NO2 ↑ + O2 ↑ + 2 H2O;
4HNO3 4NO2 ↑ + O2 ↑ + 2 H2O;
t º
2AgNO3 = 2 Ag + 2NO2 ↑ + O2 ↑ ;
Свойства азотной кислоты.
| HNO3 |


| концентрированная | разбавленная |





| Не действует на Fe, Cr, Al, Au, Pt, Ir, Ta | С другими тяжелыми металлами | Со щелочными и щелочноземельными металлами | С щелочноземельными металлами, а также с Zn и Fe | C тяжелыми металлами |




| NO2 | N2O | NH3 (NH4 NO3) | NO |
Разложение нитратов.
Левее Mg

 МеNO2 + O2 ↑ (Li….Ca)
МеNO2 + O2 ↑ (Li….Ca)
t º от Mg до Cu

 Нитрат Ме(NO3)n оксид MeO + NO2 ↑ + O2 ↑ (Mg…Cu)
Нитрат Ме(NO3)n оксид MeO + NO2 ↑ + O2 ↑ (Mg…Cu)
Правее Сu
 Me + NO2 ↑ + O2 ↑ (Ag…Pt)
Me + NO2 ↑ + O2 ↑ (Ag…Pt)
Свойства Р.

 →Сl2 t ° РCl3 ; РCl5
→Сl2 t ° РCl3 ; РCl5
 Р → → S t ° Р2S3 ; Р2S5
Р → → S t ° Р2S3 ; Р2S5
 →Мe t° Na3P; Сa3P2
→Мe t° Na3P; Сa3P2
 →O2 t° Р4O6, Р4O10.
→O2 t° Р4O6, Р4O10.
 →KOH t° РH3 + KH2 PO2
→KOH t° РH3 + KH2 PO2
 → HNO3 конц. H3 PO4 + NO2
→ HNO3 конц. H3 PO4 + NO2
Свойства Р4O10.

 → H2O HPO3
→ H2O HPO3
 Р4O10→ → H2O t ° H3PO4
Р4O10→ → H2O t ° H3PO4
 → Li2O t° Li3 PO4
→ Li2O t° Li3 PO4
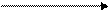 → NaOH Na3PO4; Na2 НPO4; NaН2PO4;
→ NaOH Na3PO4; Na2 НPO4; NaН2PO4;
Свойства H3PO4 (ортофосфорная кислота).

 → Na Na3PO4 + H2↑
→ Na Na3PO4 + H2↑
 H3PO4 → → Na2O Na3PO4 + H2O
H3PO4 → → Na2O Na3PO4 + H2O
 → NaOH Na3PO4; Na2 НPO4; NaН2PO4.
→ NaOH Na3PO4; Na2 НPO4; NaН2PO4.
 → Na2CO3 Na2 НPO4 + CO2 ↑
→ Na2CO3 Na2 НPO4 + CO2 ↑
Качественная реакция на PO4 3─
3 Ag+ + PO4 3─ = Ag3PO4 ↓ (желтого цвета);
Свойства О2.

 →Н2 t° H2 О
→Н2 t° H2 О
 О2 → → S t° SО2
О2 → → S t° SО2
 →Мe t° СaО; Li2O (оксиды)…
→Мe t° СaО; Li2O (оксиды)…
 →Me (I-Aгруппа, кроме Li) Na2O2; K2O2 (пероксиды)
→Me (I-Aгруппа, кроме Li) Na2O2; K2O2 (пероксиды)
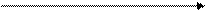 →P t° P4O10 (P2O5)
→P t° P4O10 (P2O5)
 → N2 t° NO
→ N2 t° NO
 →CS2 t° CO2 + SO2
→CS2 t° CO2 + SO2
 →H2S (избыток О2) H2O + SO2
→H2S (избыток О2) H2O + SO2
 → H2S (недостаток О2) H2O + S ↓
→ H2S (недостаток О2) H2O + S ↓
 → SO2 t° SO3
→ SO2 t° SO3
Получение кислорода:
1. Из воздуха.
2. Электролиз воды.
t°
3. 2KClO3 = 2KCl + 3O2↑;
t°
4. 2H2O2 = 2H2O + O2↑;
t°
5. 2KMnO4 = K2MnO4 + MnO2 + O2↑;
Свойства серы.

 →H2 t ° H2S;
→H2 t ° H2S;
S →  →Мe t° Na2 S; (сульфиды)
→Мe t° Na2 S; (сульфиды)
 →O2 t° SO2 ;
→O2 t° SO2 ;
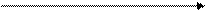 →KOH t° K2S + K2 SO3 + H2O
→KOH t° K2S + K2 SO3 + H2O
 → K2 SO3 t° K2 S2O3
→ K2 SO3 t° K2 S2O3
Свойства H2S

 → O2 t ° S + H2O
→ O2 t ° S + H2O
 H2S → → O2 (избыток) t ° SO2 + H2O
H2S → → O2 (избыток) t ° SO2 + H2O
 → Cl2 S + HCl
→ Cl2 S + HCl
 → CuSO4 CuS↓ + H2 SO4
→ CuSO4 CuS↓ + H2 SO4
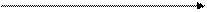 → SO2 S + H2O
→ SO2 S + H2O
 → Li Li2 S + H2
→ Li Li2 S + H2
 → Li2O Li2 S + H2O
→ Li2O Li2 S + H2O
 → LiOH Li2 S + H2O
→ LiOH Li2 S + H2O
Свойства SO2.
 → O2 (кат.) t° SO3
→ O2 (кат.) t° SO3
 SO2 → → H2O H2SO3
SO2 → → H2O H2SO3

 → H2S S + H2O
→ H2S S + H2O
 → Li2O Li2 S O3
→ Li2O Li2 S O3
 → LiOH Li2SO3 + H2O
→ LiOH Li2SO3 + H2O
Серная кислота H2SO4 .
Качественная реакция на сульфат-ион SO4 2─ :
Ba2+ + SO4 2─ = BaSO4 ↓