Опасность окислительных повреждений липидов для организма связана с тем, что они представляют собой основной материал клеточных мембран (для эукариотических организмов вся организация внутриклеточного метаболизма, реализуемая компартментализацией его отдельных процессов, обеспечивается именно биологическими мембранами). Отличительной особенностью окислительного повреждения липидов в составе биологических мембран является аккумуляция молекулярного кислорода в гидрофобной области их жирнокислотных остатков. В результате этого, а также тесного и параллель-ного расположения друг по отношению друга соседних жирнокислотных ос-татков создаются условия для реализации окислительных повреждений по ти-пу цепных реакций. Благодаря ключевой роли в таком процессе органических гидропероксидов (пероксидов (перекисей)) данный процесс получил название перекисного окисления липидов (ПОЛ).
Перекисное окисление липидов является одним из основных типов по-вреждения биологических мембран и происходит при многих патологических процессах в живом организме. Основная цепь превращений при перекисном окислении липидов (ПОЛ) может быть представлена четырьмя этапами: 1) инициирование цепи (инициация) процесса ПОЛ; 2) продолжение (рост) цепи ПОЛ; 3) разветвление цепи (амплификация процесса); 4) обрыв цепей (терминация процесса).
Инициируют ПОЛ следующие процессы: разложение присутствующих в материале гидропероксидов в результате акцепции электрона у восстанов-ленных ионов переходных металлов или их окисления гидропероксидным (супероксидным) и другими радикалами, либо окисленным ионом металла; присоединение свободного радикала к двойной связи ненасыщенной жирной кислоты; присоединение синглетного кислорода к двойной связи с последую-щим разложением образовавшегося пероксида и др. Полиненасыщенные жирные кислоты фосфолипидов клеточных мембран особенно легко подвергаются атаке свободными радикалами. Обусловлено это тем, что двойные связи у таких кислот соединены друг с другом че-рез цис-метиленовые структуры (-СН2-). Такие бис-аллильные участки позволяют электрону делокализоваться на пяти углеродных атомах и обеспечивают более легкий отрыв радикалом атома водорода у метилена, чем у -СН2- насыщенной структуры (энергия диссоциации С-Н-связи в бис-аллильном участке (около 314 кДж/моль) значительно ниже, чем у вторичного углерода, который не окружен двойными связями (около 397 кДж/моль)):
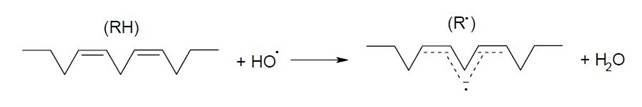
Поэтому бис-аллильные участки полиненасыщенных жирных кислот атакуются гидроксильным, алкоксильным, пероксидным радикалами, что является важным условием как для продолжения, так и развития процесса ПОЛ. Менее эффективен в этом отношении гидропероксильный радикал (НО2•), сродство к электрону у которого (293 кДж/моль) лишь несколько уступает значению энергии диссоциации С-Н связи в бис-аллильном участке жирных кислот.
Последовательность реакций развития процесса ПОЛ можно представить следующей схемой:
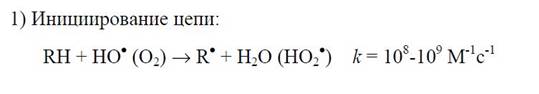

(взаимодействие с антиоксидантами - "ловушками" радикалов, где InH – антиоксидант).
На основе металлзависимых реакций и формируется своеобразный "реактор" для редокс-каталитической наработки свободных радикалов:
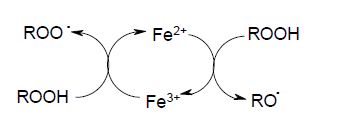
среди которых алкоксильные радикалы (RО•) обладают достаточной способностью окислять интактные молекулы и интенсифицировать процессы ПОЛ. Аналогичную роль в качестве каталитических центров в таком реакторе могут выполнять и ионы меди (Сu+/Сu2+). Реакция роста цепи определяет скорость всего суммарного процесса, как самая медленная стадия. В присутствии кислорода концентрация RОО•, как правило, превышает концентрацию R•, то есть обрыв цепи осуществляется рекомбинацией двух пероксидных радикалов с образованием практически «мгновенно» распадающегося на соответствующие альдегиды, кетоны и спирты тетраоксида.
В зависимости от природы липопероксида (ROO•) результатом реакции могут быть кетоны в электронно-возбужденном состоянии (3RО) и кислород в основном состоянии. Релаксация таких кетонов из триплетного в основное состояние сопровождается свечением в интервале длин волн 420-520нм (длина волны излучения зависит от природы R и его окружения).
По активности образующиеся свободнорадикальные производные липидов и гидроксильного радикала можно расположить в следующий ряд: НО•> RО•> RОО•. Этой последовательности соответствуют и установленные значения редокс-потенциалов таких интермедиатов. При соотнесении значений редокс-потенциалов радикальных интермедиатов липидов с аналогичными параметрами интермедиатов восстановления О2 (редокс-потенциал отсутствующего на этой схеме аллильного радикала, составляет величину, близкую к +0.6В):
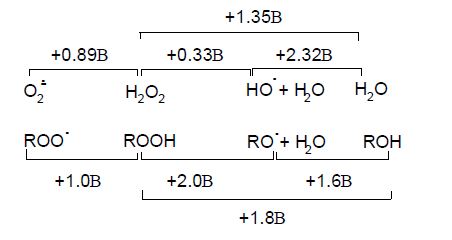
видно, что RООН является более сильным акцептором электронов, чем Н2О2 (как в случае одноэлектронного, так и двухэлектронного пути восстановления). В отличие от возможности реализации реакции, аналогичной реакции Фентона, при взаимодействии супероксидного радикала с гидропероксидом может наблюдаться не только разложение последнего до алкоксильного радикала (процесс, аналогичный реакции Габера-Вейса), но и его депротонирование:
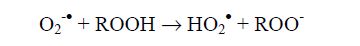
Следовательно, даже при отсутствии свободных ионов водорода в липидной фазе биологических мембран может происходить протонирование супероксидного радикала. Обусловлено это тем обстоятельством, что в гидрофобном окружении этот анион-радикал выступает сильным основанием. Так как О2-• заряжен, он не способен проникать в липидное окружение. Единственным источником его в мембранах клеток выступают электрон-транспортные цепи, шунтируемые молекулярным кислородом. В свою очередь, образующаяся в результате этой реакции протонированная форма супероксидного радикала при взаимодействии с аналогичным гидропероксидом дает пероксидный радикал:
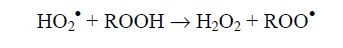
Если О2-• не способен непосредственно инициировать процессы ПОЛ, реагируя с нативным липидом, то этим свойством обладает его протонированная форма - гидропероксидный радикал:
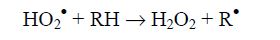
По современным представлениям липиды биологических мембран, в структуре которых в качестве обязательного компонента присутствуют полиненасыщенные жирные кислоты, являются более чувствительными к окислению описанного типа, чем белки, сахара или нуклеиновые кислоты. В случае липидов длина цепи свободно-радикальной цепной реакции является более протяженной, чем при аналогичном процессе для белков, углеводов или нуклеиновых кислот. Обусловлено это тем, что полиненасыщенные жирные кислоты в подавляющем большинстве случаев этерифицируют глицерольную часть фосфолипида в позиции sn-2. В результате становится возможным оптимальный перенос свободного радикала (точнее - свободной валентности) между «параллельно» расположенными бис-аллильными структурами жирнокислотных цепей в липидном бислое.
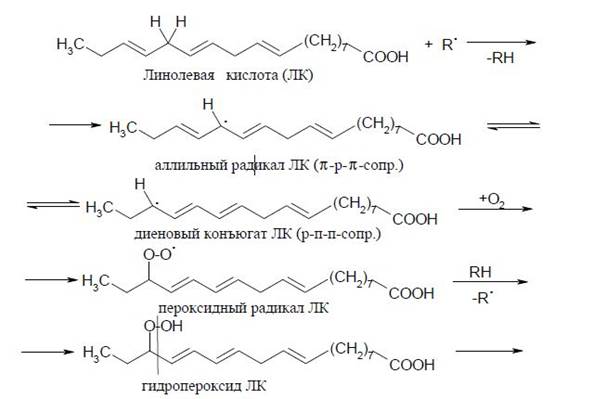
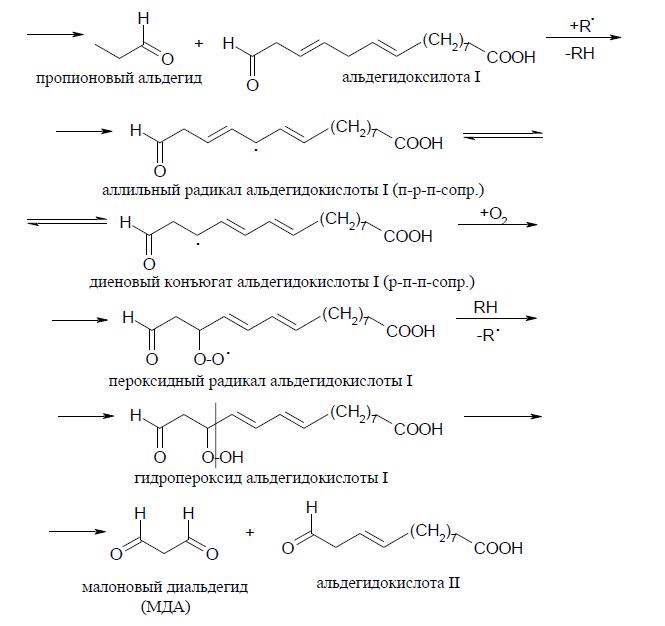
Образующиеся в качестве первичных продуктов диеновые гидропероксиды нестабильны и могут, подвергаясь вторичным реакциям, приводить к образованию эпоксидов, альдегидов, кетонов, спиртов и карбоновых кислот. Часто эти производные являются высоко токсичными. В конечном счете для самих биомембран описанный процесс ведет к структурной модификации их липидов. Однако такая модификация не ограничивается только убылью неокисленных и нарастанием гидроксилированных жирных кислот, а также увеличением количества относительно стабильных гидропероксидов (в отсутствие восстановленных ионов металлов переходной группы или НО2•/О2). Среди продуктов окисления полиненасыщенных жирных кислот образуются такие биологически активные соединения как малоновый диальдегид и α,β-ненасыщенные альдегиды (акролеин, 4-гидрокси-2-алкенали), а также α-гидроксиальдегиды. Определение количеств образующихся диеновых конъюгатов, малонового диальдегида и других продуктов ПОЛ используется для оценки интенсивности процессов перекисного окисления в биологическом материале (липиды биомембран). На примере окисления линолевой кислоты процесс окисления можно представить последовательностью реакций, изображенной на схеме 1.
Таким образом, окисление приводит к повреждению биомембран. Биологические последствия такого повреждения мембран для жизнедеятельности клетки следующие:
1. действие перекисного окисления на мембранные белки: окисление SH-групп белков; повреждение переносчиков; появление проницаемости для ионов; повреждение транспортных АТФаз;
2. действие перекисного окисления на липидный слой мембран: увеличение микровязкости мембран; изменение поверхностного заряда мембран и липопротеидов; уменьшение гидрофобного объема; увеличение полярности липидной фазы; увеличение проницаемости для ионов водорода и кальция.
Несмотря на то, что перекисное окисление приводит к деструктивным процессам в биологических мембранах, некоторое количество продуктов ПОЛ постоянно присутствует в мембранах клеток, и уровень их содержания связан с функциональным состоянием клетки. Следовательно, продукты ПОЛ являются обязательными структурными элементами клеточных мембран, количественное содержание которых находится под строгим контролем. Продукты ПОЛ оказывают влияние на фазовое состояние липидного бислоя, усиливают гидратацию поверхности клетки, модифицируют проводимость мембраны для ионов и малых молекул и др. В организме существует физиологический путь генерации пероксидов липидов, механизм которого принципиально отличается от выше описанного механизма самопроизвольных цепных реакций ПОЛ. "Санкционированно" продуцируемые гидро- и эндоперекиси липидов образуются в активных центрах специализированных для этой цели ферментов (циклооксигеназа и липоксигеназа). Структурно они строго стереоспецифичны и обладают важнейшими биологическими функциями.
Схема 1 Механизм перекисного окисления липидов на примере окисления линоленовой кислоты.