Серная кислота – наиболее сильная и самая дешевая кислота. Среди минеральных кислот, производимых химической промышленностью, серная кислота по объему производства и потребления занимает первое место. Серная кислота является одной из самых сильных кислот, в широком диапазоне температур (от -40..-20 до 260 - 336,50С) находится в жидком состоянии. Она широко используется в производстве минеральных удобрений, различных солей и кислот, органических продуктов, красителей, дымообразующих и взрывчатых веществ и т.д. Серная кислота находит разнообразное применение в нефтяной, металлургической, металлообрабатывающей, текстильной, кожевенной и других отраслях промышленности, используется в качестве водоотталкивающего и осушающего средства, применяется в процессах нейтрализации, травления и т.д.
В настоящее время серная кислота производится двумя способами: нитрозным и контактным, освоенным в промышленности в конце XIX и начале XX. Контактный способ вытесняет нитрозный (башенный). Первой стадией сернокислотного производства по любому методу является получение диоксида серы при сжигании сернистого сырья. После очистки диоксида серы (особенно в контактном методе) ее окисляют до триоксида серы, который соединяется с водой с получением серной кислоты. Окисление SO 2 в SO 3 в обычных условиях протекает крайне медленно. Для ускорения процесса применяют катализаторы.
В контактном методе производства серной кислоты окисление диоксида серы в триоксид осуществляется на твердых контактных массах.
Контактным способом производится большое количество сортов серной кислоты, в том числе олеум, содержащий 20% SO3, купоросное масло (92,5% H2SO4 и 7,5% H2O), аккумуляторная кислота примерно такой же концентрации, как и купоросное масло, но более чистая. Эту схему производства серной кислоты можно назвать классической.
|
|
Достоинством классической схемы производства контактной серной кислоты является абсолютная надёжность.
Недостатками:
- громоздкость схемы;
- большие материальные затраты на строительство в целом и очистного отделения в частности.
На установках большой производительности невозможно достичь 100% степени переработки сернистого ангидрида в серный. Это связано с тем, что полученный серный ангидрид продолжает оставаться в зоне реакции, что смещает равновесие реакции, окисление в сторону исходных веществ.
При нитрозном способе катализатором служат оксиды азота. Окисление SO 2 происходит в основном в жидкой фазе и осуществляется в башнях с насадкой. Поэтому нитрозный способ по аппаратному признаку называют башенным. Сущность башенного способа заключается в том, что газ, полученный при сжигании сернистого сырья и содержащий примерно 9% SO 2 и от девяти до десяти % O 2, очищается от частиц колчеданного огарка и поступает в башенную систему, которая состоит из нескольких (четырех – семи) башен с насадкой. Башни с насадкой работают по принципу вытеснения при политермическом режиме. Температура газа на входе в десорбционных процессов, осложненных химическими превращениями. В первых двух – трех башнях насадка орошается нитрозой, в которой растворенные оксиды азота химически связанны в виде нитрозилсерной кислоты NOHSO 4.
При высокой температуре нитрозилсерная кислота гидролизуется. Процесс описывается уравнением реакции:
|
|
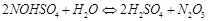 (3.5)
(3.5)
Диоксид серы абсорбируется водой и образует сернистую кислоту. Процесс можно описать уравнением:
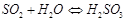 (3.6)
(3.6)
Последняя реагирует с оксидами азота в жидкой фазе. Процесс описывается уравнением реакции:
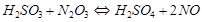 (3.7)
(3.7)
Частично SO2 может окисляться в газовой фазе. Процесс можно описать уравнением реакции:
 (3.8)
(3.8)
SO3, абсорбируясь водой, также дает серную кислоту. Процесс описывается уравнением реакции:
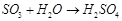 (3.9)
(3.9)
Оксид азота десорбируется в газовую фазу и окисляется до диоксида азота кислородом воздуха. Процесс описывается уравнением реакции:
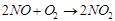
Оксиды азота
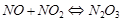
поглощаются серной кислотой в последующих трех – четырех башнях. Для этого в башни подают охлажденную серную кислоту с малым содержанием нитрозы, вытекающую из первых башен. При абсорбции оксидов получается нитрозилсерная кислота. Таким образом, оксиды азота совершают кругооборот и теоретически не должны расходоваться. На практике же из-за неполноты абсорбции имеются потери оксидов азота. Расход оксидов азота в пересчете на HNO 3 составляет 10-20 кг на тонну моногидрата H2SO4. Нитрозным способом получают загрязненную примесями и разбавленную 75 – 77%-ную серную кислоту, которая используется в основном для производства минеральных удобрений.
Недостатки нитрозного метода:
- С его помощью невозможно получить олеум и затруднено получение кислоты с концентрацией выше 75%;
- Кислота загрязнена окислами азота, которые резко изменяют её коррозионные свойства;
- Из-за отсутствия системы очистки, кислота загрязнена окислами As и Se.
|
|
Промышленность выпускает три вида товарной серной кислоты:
- Башенная кислота: С=75%, tкрист= -29,50С;
- Контактная кислота: С=92,5%, tкрист= -22,00С;
- Олеум: С=20% своб. SO3, tкрист= +20С
Сырьем для производства серной кислоты являются элементарная самородная сера, механически смешанная с другими минералами; сернистые металлы (сульфиды), такие, как пирит FeS 2, медный колчедан FeCuS 2, медный блеск Cu 2 S, цинковая обманка ZnS, а также PbS, CoS, NiS и др.; сульфаты: гипс, ангидрит, а также Na 2 SO 4, MgSO 4 и др. Значительное место в сырьевом балансе занимают отходящие газы цветной металлургии, содержащие диоксид серы. Производство серной кислоты контактным методом из колчедана состоит в том, что очищенный от пыли обжиговый газ подвергается специальной очистке от примесей, после чего полученный диоксид серы, проходя через катализатор (контактную массу), окисляется до триоксида, который, соединяясь с водой, образует серную кислоту. При избытке или недостатке воды получают соответственно водный раствор серной кислоты или олеум.
Принципиальная схема производства серной кислоты из колчедана может быть оформлена различно; на схеме, приведенной на рис. 3.21, раскрыто технологическое содержание производства. В частности, видно, что оно представляет собой схему с открытой цепью, т.е. является проточной схемой, где газ последовательно проходит все аппараты. [2]
 .
.
Рис. 3.21. Принципиальная схема производства серной кислоты контактным методом из колчедана: 1 – обжиг флотационного колчедана и получение обжигового газа; 2 - охлаждение газа в котле-утилизаторе; 3 – очистка газа от пыли; 4 – промывка и осушка газа; 5 – подогрев газа; 6 – окисление в на катализаторе; 7 – абсорбция с образованием серной кислоты.
Схема включает 7 основных операций. Из нагнетателя газ проходит в печь с кипящим слоем, где происходит обжиг сырья. В процессе обжига содержащийся во флотационном колчедане пирит вступает во взаимодействие с кислородом воздуха. В результате образуются диоксид серы, содержащий от 12 до 15% SO 2, и огарок Fe 2 O 3.
Далее диоксид серы охлаждают с использованием тепла для получения пара. Полученный диоксид серы освобождают от пыли. Далее диоксид серы подвергают специальной очистке (охлаждение, промывка, сушка). Очищенный SO 2 нагревают теплом отходящих газов. В присутствии катализатора очищенный SO 2 окисляется до SO 3. После окисления газ охлаждают (операция 5) и направляют на абсорбцию SO 3 98,3%-ной серной кислотой. При этом триоксид серы реагирует с водой, образующуюся серную кислоту выводят из процесса в качестве готового продукта. [2]
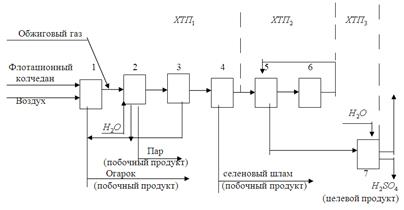
Схематически процесс получения серной кислоты из колчедана можно представить в виде схемы (рис. 3.22) [7]
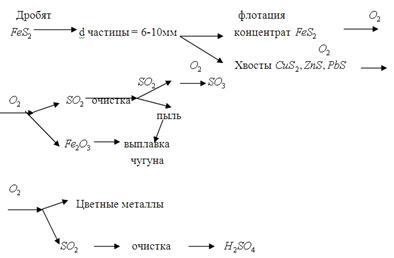
Рис. 3.22. Технологическая схема получения серной кислоты из колчедана
Печь для обжига представляет собой аппарат грушевидной формы, выложенный изнутри огнеупорным кирпичом. Сверху загружают пирит, снизу вдувается воздух, обогащенный кислородом для создания эффекта «кипящего слоя».  подается непрерывно, температура вследствие кипящего слоя везде одинакова. Для поддержания оптимальной температуры в нижней части печи расположен холодильник. Продукты обжига SO 2 идет на дальнейшее окисление, Fe 2 O 3 идет на получение цемента, микроудобрений, минеральных красок.
подается непрерывно, температура вследствие кипящего слоя везде одинакова. Для поддержания оптимальной температуры в нижней части печи расположен холодильник. Продукты обжига SO 2 идет на дальнейшее окисление, Fe 2 O 3 идет на получение цемента, микроудобрений, минеральных красок.
Очистка печного газа происходит в циклонах, электрофильтрах и сушильной башне.
При контактном окислении SO 2 до SO 3 печной газ SO 2 предварительно перед окислением попадает в теплообменник (рис. 3.23а) проходя между трубками, где нагревается за счет тепла отходящего газа SO 3, а затем попадает в контактный аппарат (рис. 3.23, б), проходя между трубок теплообменника, расположенного под полками с катализатором. Температура газа для окисления на верхней полке катализатора увеличивается до 620 °C. Реакция происходит быстро и достигается высокий процент контактирования. В последующих слоях температура газа снижается за счет отдачи тепла новым порциям обжигового газа. Оптимальная температура на выходе 420 °C. В промышленном производстве используется 4-5 полок, а продолжительность окисления 3-4 секунды.
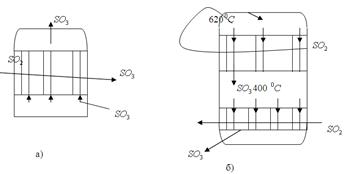
Рис.3.23. Приборы для контактного окисления SO 2 до SO 3:
а) теплообменник; б) контактный аппарат
Поглощение серного ангидрида в серную кислоту или олеум происходит в специальной поглотительной башне (рис. 3.24)

Рис. 3.24. Поглотительная башня
Диоксид серы SO 2 оказывает сильное токсическое действие уже при концентрации в воздухе 0,25 – 0,50 мг/м3, а при средней концентрации более 0,50 г/м3 отмечается повышение смертности и числа госпитализаций. В нашей стране на SO 2 установлены предельно допустимые концентрации:
Для улавливания брызг серной кислоты в контактных системах устанавливают брызгоуловители – насадочные башни, по конструкции аналогичные второму абсорберу. На некоторых заводах отдельный насадочный брызгоуловитель заменен неорошаемым слоем насадки в верхней части последнего абсорбера. Вместо насадочных брызгоуловителей применяются также циклоны. Если степень контактирования недостаточна, приходится сооружать специальную установку для улавливания SO 2 из отходящих газов или направлять их в высокую трубу для рассеивания в верхних слоях атмосферы. При улавливании SO 2 содовым или аммиачным раствором присутствующие в газе остатки SO 3 образуют сернокислотный туман, для улавливания которого требуется мокрый электрофильтр.