Аллостерические эффекты в гемоглобине. При взаимодействии О2 с дезоксигемоглобином (T -форма гемоглобина) образуется оксигемоглобин (или R -форма), при этом валентность железа в геме не меняется (это реакция оксигенации, а не окисления!). Молекула гемоглобина связывает 4 молекулы кислорода, иначе говоря, гем каждой субъединицы связывает одну молекулу кислорода. Один грамм НbA1 присоединяет 1,34 см3 О2. Эта величина называется константой Хюфнера. С помощью этой константы можно определить, какое количество О2 содержится в крови, зная концентрацию НbA1.
T -форма гемоглобина обладает значительно более низким сродством к кислороду по сравнению с R -формой. Связывание молекулы О2 с гемом одной из субъединиц Т -формы приводит к конформационным изменениям, которые ослабляют связь между субъединицами. С увеличением парциального давления кислорода (Ро2) в эритроците возрастает количество молекул НbA1 в R -форме.
Кривая насыщения гемоглобина кислородом представлена на рис. 1. S -образность формы кривой означает, что связывание кислорода гемоглобином происходит кооперативно, т. е. присоединение кислорода к одному гему за счет ослабления связей между субъединицами облегчает его присоединение к следующим гемам в составе тетрамера. Так, четвертая молекула О2 присоединяется к гемоглобину в 300 раз легче, чем первая молекула (рис. 1). Кооперативность процесса обеспечивает возможность насыщения крови кислородом при изменении его парциального давления в довольно широких пределах. Например, дыхательная функция крови существенно не нарушается при снижении Ро2 в альвеолярном воздухе с 133,3 до 80–97 кПа. Поэтому подъем на высоту 3,0–3,5 км над уровнем моря не сопровождается развитием выраженной гипоксемии.
Кривая диссоциации для гемоглобина также имеет S -образную форму. И при диссоциации протомеры работают кооперативно – чем больше О2 отдают протомеры, тем легче идет отщепление последующих молекул О2.
Равновесие между Т - и R -формами регулируется аллостерическими факторами. Положительным гомотропным эффектором является непосредственно сам О2, так как с повышением его концентрации увеличивается константа связывания. Гетеротропными эффекторами служат СО2, ионы Н+ и 2,3-дифосфоглицерат. 2,3-дифосфоглицерат избирательно связывается с Т -формой (дезокси-Hb). Это увеличивает равновесную долю дезокси-Hb в паре Hb/дезокси-Hb. В результате повышается высвобождение О2 при постоянстве Ро2. Аналогично 2,3-дифосфоглицерату действуют СО2 и Н+-ионы.
Насыщение гемоглобина кислородом и диссоциация оксигемоглобина зависят:
1) от рН – чем ниже рН, тем меньше способность HbA1 связывать О2. В тканевых капиллярах рН ниже (много СО2), в легких – выше, так как СО2 выделяется, рН повышается и HbA1 активно присоединяет О2;
2) температуры – чем выше температура, тем меньше сродство HbA1 к О2. В тканях температура выше, чем в легких;
3) концентрации HbA1, соотношения разных его форм, возраста и др.
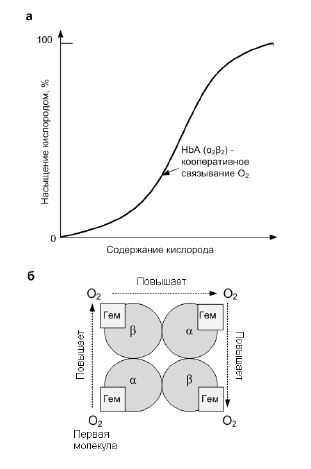
Рис. 1 – Механизм взаимодействия гемоглобина с кислородом.
а – график насыщения гемоглобина кислородом; б – кооперативный характер насыщения гемоглобина.
Транспорт углекислого газа эритроцитами. Ранее считалось, что молекулы CO2, которые выделяются из метаболизирующих тканей, транспортируются аминогруппами первых аминокислот b-цепей гемоглобина. На настоящий момент механизм транспорта представляется иначе. Молекулы CO2, диффундируют из тканей в кровь и затем попадают в эритроциты. В эритроцитах фермент карбоангидраза катализирует реакцию между CO2 и водой вследствие чего образуется угольная кислота. Последняя диссоциирует и в эритроцитах венозной крови повышено содержание углекислого газа приведенного к виду гидрокарбонат и карбонат ионов. Эти ионы растворяются в цитозоле эритроцитов и переносятся либо в свободной форме или связываются посредством ионных взаимодействий с аминогруппами первых аминокислот a- и b-цепей гемоглобина. В легких реакция идет в обратном направлении и CO2 в конечном счете выделяется в окружающую среду.
Антиоксидантная система эритроцитов. Высокое содержание кислорода в эритроцитах инициирует образование супероксидного анион-радикала (О2 ˙ –), гидроксильного радикала (ОН ˙) и пероксида водорода (Н2О2). Активные формы кислорода образуются постоянно, их основным источником является неферментативное окисление Нb в MtHb.
Активные формы кислорода и радикалы могут вызывать гемолиз эритроцитов. Предотвращает их токсическое действие специализированная неферментативная и ферментная системы защиты. Антиоксидантами служат витамины С, Ε и др. Также антиоксидантная система эритроцитов представлена такими ферментами, как супероксиддисмутазой, каталазой, глутатионпероксидазой, глутатионредуктазой. Для ее работы необходимы восстановленный глутатион (GSH) и НАДФН+Н+, образующийся в основном в пентозофосфатном цикле.
При недостаточной активности ферментов обезвреживания активных форм кислорода или поступлении в организм ксенобиотиков, инициирующих образование метгемоглобина, концентрация последнего возрастает. Между протомерами метгемоглобина образуются дисульфидные связи, протомеры полимеризуются в агрегаты, называемые тельцами Хайнца. Под их влиянием эритроциты разрушаются. Антиоксидантные системы функционируют и в других клетках крови.