Ключевая роль крови в поддержании гомеостаза и доступность для исследований сделали эту ткань важнейшим объектом биохимии. Химический состав крови в норме относительно постоянен. Все случайные колебания в ее составе в здоровом организме быстро выравниваются, что обусловлено функционированием ЦНС и гуморальной системы регуляции.
Биохимические функции крови выполняются химическими компонентами плазмы (55 % от объема крови) и клеток крови – эритроцитов (44 %), нейтрофилов, базофилов, эозинофилов, моноцитов, лимфоцитов, тромбоцитов (1 %). К ним следует отнести:
транспортную (транспорт газов, питательных веществ, метаболитов, продуктов обмена веществ, гормонов);
защитную (выполнение комплекса специфических и неспецифических защитных реакций – выработка иммуноглобулинов, интерферонов, осуществление фагоцитоза и др.);
гемостатическую (наличие мощных свертывающей и противосвертывающей систем);
обезвреживающую (участие в биотрансформации ксенобиотиков, инактивации свободных радикалов, удалении токсичных веществ, образующихся в метаболических путях в норме, связывании и инактивации гормонов, витаминов);
регуляторную (образование регуляторов обмена веществ органов и тканей. Выработка гистамина, серотонина гепарина, кининов и др.);
гомеостатическую (поддержание химического состава; постоянства рН; ионного состава; осмотического и онкотического давления – 7,8–8,1 атм.; температуры).
Клетки и белки, депонирующие и транспортирующие кислород, отвечающие за утилизацию углекислого газа и ряд важных дополнительных функций. То есть клетки крови морфологически и биохимически специализированы на выполнение определенных функций.
Эритроцит на 70 % состоит из воды и на 30 % из сухого остатка. В сухом остатке 95 % составляет гемоглобин (НbA1), 5 % – глюкоза и другие вещества, необходимые для обеспечения биохимических процессов.
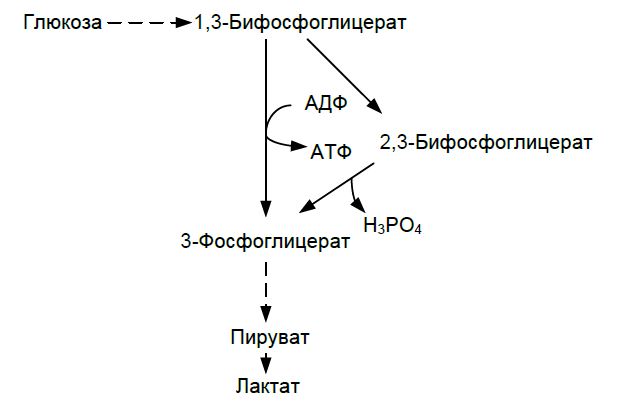
Около 90 % энергии АТФ эритроциты получают путем гликолитического окисления глюкозы до молочной кислоты. Глюкоза поступает из плазмы, ее потребность в норме в среднем составляет 0,7 г в час. Важной особенностью гликолиза в эритроцитах является образование 2,3-дифосфоглицерата из 1,3-дифосфоглицерата под действием дифосфоглицератмутазы (рис. 1), Эта реакция протекает только в эритроцитах и называется шунт Раппопорта.
2,3-дифосфоглицерат служит регулятором присоединения О2 к гемоглобину (НbA1). В клетках активно протекает пентозофосфатный цикл окисления глюкозы (10 %). Энергия АТФ (~90 %) наиболее интенсивно тратится на поддержание трансмембранного градиента ионов Na+ и K+, работу Na+, K+-АТФ-азы.
Гемоглобин. Основная функция эритроцитов – связывание и перенос О2 от лѐгких к тканям, а СО2 – от тканей в лѐгкие – осуществляется сложным белком гемоглобином (НbA1). Общее содержание гемоглобина в крови 130–160 г/л или 750 г, в одном эритроците около миллиона молекул.
За время своего существования (120 дней), эритроцит переносит от лёгких к тканям до 1 млрд. молекул О2. Транспорт газов гемоглобином осуществляется благодаря особому строению и свойствам этой уникальной молекулы.
Гемоглобин – сложный белок из класса глобулярных белков – хромопротеинов состоит из протеина глобина и группы гема. Глобин содержит 4 субъединицы или полипептидные цепи, состоящие из 374 аминокислотых остатков, с М.м ~ 16 кДа. 80 % аминокислотных остатков каждой субъединицы образуют 8 α-спиральных участков, обозначаемых A, B, C, D, E, F, G, H. Аминокислотная последовательность субъединиц (α, β, γ, δ) различается, это определяет наличие разных типов гемоглобинов. С каждой субъединицей связана одна группа гема.
Гем состоит из органической части, которая включает атом железа. Органическая часть образована протопорфирином IX. В протопорфирине четыре пиррола соединяются метиленовыми мостиками, образуя тетрапиррольное кольцо. Атом железа в геме присоединен к 4-м атомам азота в центре протопорфиринового кольца и образует еще две координационные связи с остатками гистидина белковой части НbA1 (рис. 2).
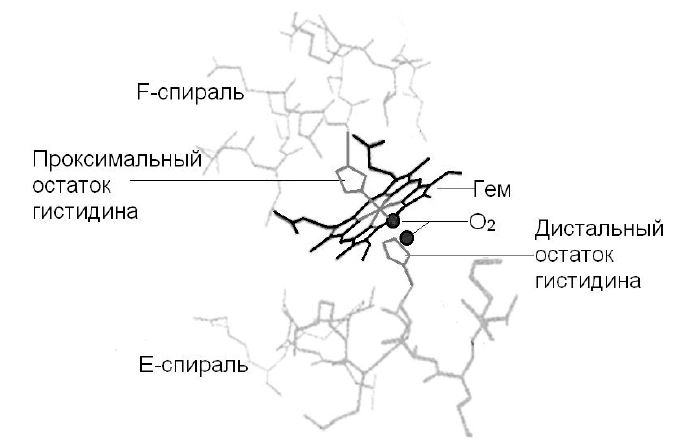
Рис. 2. – Соединение белковой части глобина с гемом, содержащим ион железа II.
Железо в геме может быть в ферроформе (Fe2+) или в ферриформе (F3+). Соответствующие формы называются феррогемоглобином или ферригемоглобином. Связывать О2 способен только феррогемоглобин. Красный цвет гемоглобина обусловлен наличием Fe2+. Замена его, например на Сu2+ (гемоцианины головоногих моллюсков), определяет развитие голубой окраски крови.
В ретикулоцитах происходит координированный синтез цепей глобина на полирибосомах, он контролируется генами 11-й и 16-й хромосом. Гем синтезируется во всех тканях, но с наибольшей скоростью в костном мозге и печени. В костном мозге гем используется для синтеза гемоглобина в ретикулоцитах, в гепатоцитах – для образования цитохрома Р450.
В организме человека происходит постоянное разрушение эритроцитов – примерно 100–200 млн. в час. Деградация освободившегося гемоглобина начинается в микросомальной фракции ретикуло-эндотелиальной системы, клеток печени, селезенки и костного мозга. Там происходит отделение гема от глобина.
Глобин, как и другие белки, расщепляется внутриклеточными экзо-, эндо- и дипептидазами. Система деградации белков локализована в цитоплазме, она хорошо регулируема и состоит из протеасом – больших белковых комплексов с М.м. 2•106 Да. Протеасомы содержат бочковидное ядро, состоящее из 28 субъединиц, с коэффициентом седиментации 20S. Протеазы локализованы внутри ядра. С двух торцевых сторон протеасом располагаются сложно устроенные 19S-частицы, контролирующие доступ белка в ядро.
Белки, которым предстоит разрушение в протеасоме, ковалентно присоединяют активированный убиквитин – небольшой белок. Биосинтез происходит за счет энергии тиосложноэфирной связи, имеющейся в нем. Убиквитинированные (меченые убиквитином) молекулы распознаются 19S-частицами, которые пропускают их в ядро с затратой АТФ. В ядре происходит поэтапный протеолиз белка пептидазами. Убиквитин не разрушается, он отделяется от белка, внедренного с его помощью в протеасому, активируется и используется вновь.
После отделения глобина красный гем расщепляется гемоксигеназой (необходимы О2 и НАДФН) на ионы Fe2+, СО и зеленый биливердин. Далее железо утилизируется. Биливердин восстанавливается биливердинредуктазой до оранжевого билирубина, который транспортируется кровью в комплексе с альбуминами в печень для дальнейших превращений.
Количество и состав фракций гемоглобина изменяется в процессе онтогенеза. Примером могут служить следующие физиологические типы гемоглобинов:
• примитивный гемоглобин (НbР), состоящий из двух α- и двух ε-субъединиц (2α, 2ε), синтезируется в эмбриональном желточном мешке через несколько недель после оплодотворения. Через две недели после формирования печени плода в ней начинает синтезироваться HbF, который к шести месяцам полностью замещает НbР;
• фетальный гемоглобин (HbF) – главный гемоглобин плода, который синтезируется в печени и костном мозге в антенатальный период. Состоит из двух α- и двух γ-субъединиц (2α, 2γ). Характеризуется более высоким сродством к кислороду, что обеспечивает его эффективную доставку к эмбриону из системы кровообращения матери. В крови новорожденного содержится ~ 80 % HbF. К концу 1-го года жизни он почти целиком заменяется на HbA. В крови взрослого человека в норме HbF присутствует не более 1,5 % от общего количества гемоглобина.
У взрослого человека в норме 3 типа гемоглобинов: HbA1, HbA2 и HbF. Основная форма – HbA1 (96 % от общего количества), состоящая из дух - (содержат по 141 аминокислотному остатку) и двух β-субъединиц (по 146 аминокислотных остатков). Начинает синтезироваться в клетках костного мозга уже на 8–м месяце развития плода. Около 2 % составляет HbA2, содержащий 2- и 2 цепи и менее 2 % HbF. В небольших количествах при старении в крови появляется HbA3, он также содержит 2α- и 2β-цепи, однако в строении β-цепей имеются изменения по сравнению с HbA1. Гмоглобины существуют в четырех формах:
• оксигемоглобин [НbA1(O2)4] – полностью оксигенированный гемоглобин, связанный с четырьмя молекулами кислорода;
• дезоксигемоглобин (ННbA1) – не связанный с кислородом и содержащий гем с двухвалетным железом Fe2+;
• карбоксигемоглобин (ННbA1CO) – прочное соединение HbA1 с монооксидом углерода (СО). Сродство угарного газа к HbA1 примерно в 400 раз выше, чем к О2, поэтому при повышении концентрации СО в окружающей среде быстро образуется HbСО, транспорт кислорода к тканям прекращается, развивается кислородное голодание, поражается ЦНС, и прежде всего корковые нейроны, наступает смерть от удушья;
• метгемоглобин (MtHb) – ферриформа гемоглобина, которая образуется при окислении гема дезоксигенированного HbA1 (ННb) и образовании гема с Fe3+. В результате гем утрачивает способность связываться с кислородом и транспортировать его в ткани. В сутки из гемоглобина при действии окислителей постоянно образуется около 0,5 % MtHb. К метгемоглобинобразователям относятся анилин и его производные, аминофенолы, хлораты, пероксиды, некоторые местные анестетики (например, бензокаин), нитриты и нитраты, нафталин, нитробензол и его производные, оксиды азота, некоторые сульфаниламиды и др. Гемоглобинредуктаза, присутствующая в эритроцитах, восстанавливает ферриформу до феррогемоглобина (Fe2+). При переходе ≈ 60 % Fe(II) в Fe(III) развивается тяжелейший цианоз (синюха) и наступает смерть.
В эритроцитах молекулярные формы гемоглобина способны к взаимопревращению, их соотношение определяется индивидуальными особенностями организма и экологическими условиями.
В крови людей открыто более 300 вариантов гемоглобинов, вследствие мутации генов. Существуют еще Hb: С, Д, Е, Ф, Н, 1, М, О и др.
Примером аномального гемоглобина служит гемоглобин S (HbS), в молекуле которого в 6 положении β-цепи глобина глутаминовая кислота заменяется валином. У носителей гена HbS развивается серповидноклеточная анемия. HbS после отдачи кислорода превращается в плохо растворимую форму, выпадает в осадок в виде кристаллоидов (тактоидов), они деформируют клетку, придавая ей форму серпа (полумесяца). Такие эритроциты закупоривают сосуды, создают локальную гипоксию, быстрее разрушаются и развивается гемолитическая болезнь. Дети, гомозиготные по мутантному гену, умирают в раннем возрасте. Болезнь распространена в странах Южной Америки, Африки и Юго-Восточной Азии.