1. 25%
2. 15%
3. 50%
4. 10%
4. Укажите, что называется азотистым равновесием применительно к организму человека:
1. Состояние организма, при котором количество азота, поступившего с пищей, равно количеству азота, выведенного из организма
2. Состояние организма, при котором количество азота, поступившего с пищей, больше количеству азота, выведенного из организма
3. Состояние организма, при котором количество азота, поступившего с пищей, меньше количеству азота, выведенного из организма
5. Укажите, что называется положительным азотистым балансом применительно к организму человека:
1. Состояние организма, при котором количество азота, поступившего с пищей, равно количеству азота, выведенного из организма
2. Состояние организма, при котором количество азота, поступившего с пищей, больше количеству азота, выведенного из организма
3. Состояние организма, при котором количество азота, поступившего с пищей, меньше количеству азота, выведенного из организма
6. Укажите, что называется отрицательным азотистым балансом применительно к организму человека:
1. Состояние организма, при котором количество азота, поступившего с пищей, равно количеству азота, выведенного из организма
2. Состояние организма, при котором количество азота, поступившего с пищей, больше количеству азота, выведенного из организма
3. Состояние организма, при котором количество азота, поступившего с пищей, меньше количеству азота, выведенного из организма
7. Выберите незаменимые аминокислоты:
1. Валин
2. Аланин
3. Фенилаланин
4. Серин
8. Выберите незаменимые аминокислоты:
1. Метионин
2. Фенилаланин
3. Триптофан
4. Серин
9. Выберите заменимые аминокислоты:
1. Глицин
2. Тирозин
3. Фенилаланин
4. Пролин
10. Выберите заменимые аминокислоты:
1. Валин
2. Аланин
3. Аспарагин
4. Метионин
11. Почему ряд аминокислот является незаменимыми факторами пищи:
1. Не могут всасываться в желудочно-кишечном тракте
2. Не могут синтезироваться в организме
3. Не входят в состав пищевых белков
12. Почему ряд аминокислот является незаменимыми факторами пищи:
1. Не могут всасываться в желудочно-кишечном тракте
2. Не могут синтезироваться в организме
3. Не входят в состав пищевых белков
4. Могут синтезироваться в организме из соответствующих кетокислот
13. Укажите факторы, определяющие пищевую ценность белков:
1. Наличие в составе пищевых белков всех незаменимых аминокислот
2. Наличие в составе пищевых белков всех заменимых аминокислот
3. Наличие в ЖКТ ферментов, способных расщеплять пищевые белки
4. Наличие в пище белков только животного происхождения
14. Выберите, чем определяется пищевая ценность белков:
1. Аминокислотным составом
2. Наличием заряда белковых молекул
3. Возможностью расщепления в желудочно-кишечном тракте
4. Молекулярной массой белка
15. Выберите правильные ответы. Аминокислоты используются в организме для синтеза:
1. Гема
2. Белков
3. Нейромедиаторов
4. Гормонов
5. Высших жирных кислот
6. Гормонов
16. Выберите правильные ответы. Пищевая ценность белка зависит от:
1. Присутствия всех условно заменимых аминокислот
2. Присутствия всех заменимых аминокислот
3. Порядка чередования аминокислот
4. Наличия всех незаменимых аминокислот
5. Возможности расщепления в желудочно-кишечном тракте
17. Выберите одно правильное утверждение. Полноценными считаются белки, содержащие:
1. Все заменимые аминокислоты
2. Все незаменимые аминокислоты
3. Все условно заменимые аминокислоты
18. Выберите из предложенных пептиды, имеющие оптимальный для человека состав по содержанию незаменимых аминокислот:
1. Гис-Вал-Три-Тре-Фен-Сер-Асп-Асн-Мет-Трп
2. Ала-Вал-Мет-Лей-Фен-Сер-Иле-Три-Лиз-Тре
3. Тре-Мет-Вал-Лей-Иле-Три-Фен-Глн-Лиз-Про
19. Выберите правильные ответы. Азотистое равновесие наблюдается:
1. У людей престарелого возраста
2. У здорового человека
3. При длительном заболевании
4. В период роста ребёнка
5. В период голодания
20. Выберите правильные ответы. Отрицательный азотистый баланс наблюдается:
1. У людей престарелого возраста
2. У здорового человека
3. При длительном заболевании, сопровождающейся деструкцией клеток
4. В период роста ребёнка
5. В период голодания
21. Выберите правильные ответы. Положительный азотистый баланс наблюдается:
1. У людей престарелого возраста
2. У здорового человека
3. При выздоровлении после длительного заболевания
4. В период роста ребёнка
5. В период голодания
22. В расщеплении белков в ЖКТ человека участвуют ферменты:
1. Липаза
2. Пепсин
3. Химотрипсин
4. Аминотрансфераза
23. В расщеплении белков в ЖКТ человека участвуют ферменты:
1. Трипсин
2. Пепсин
3. Амилаза
4. Сукцинатдегидрогеназа
24. Укажите условия, необходимые для переваривания белков в желудке:
1. Секреция соляной кислоты
2. Секреция гистамина
3. Превращение трипсиногена в трипсин
4. Образование пепсиногена
5. рН желудочного сока 1,5-2,5
25. Действие протеиназ на клетки желудка и поджелудочной железы предотвращает:
1. Образование слизи, содержащей гетерополисахариды
2. Выработка протеолитических ферментов в неактивной форме
3. Быстрая регенерация повреждённого эпителия
4. Синтез ферментов в активной форме
26. Выберите, какие ферменты расщепляют пептидные связи в предложенных примерах:
Фермент
1. Пепсин
2. Аминопептидаза
3. Трипсин
4. Карбоксипептидаза
5. Дипептидаза
Расщепляемая пептидная связь
А. …-Гис-Ала
Б. Тир-Ала-…
В. Арг-Мет
2Б 4А 5В
27. Протеиназы, участвующие в переваривании белков в кишечнике, синтезируются в клетках:
1. Слюнных желёз
2. Слизистой оболочки желудка
3. Поджелудочной железы
4. Печени
5. Кишечника
28. Отличие экзопептидаз от эндопептидаз заключается в том, что они:
1. Расщепляют пептидную связь в любом участке белка
2. Являются гидролазами
3. Синтезируются всегда в активной форме
4. Расщепляют пептидные связи внутри полипептидной цепи
5. Расщепляют пептидные связи N- и С-концевых аминокислот
29. В активной форме секретируется:
1. Пепсин
2. Трипсин
3. Аминопептидаза
4. Карбоксипептидаза
5. Эластаза
30. В расщеплении белков в желудке взрослого человека участвуют ферменты:
1. Липаза
2. Пепсин
3. Пепсин В
4. Трипсин
5. Аминотрансфераза
31. В расщеплении белков в желудке взрослого человека участвуют ферменты:
1. Гастриксин
2. Пепсин
3. Пепсин В
4. Трипсин
32. Оптимальное значение рН для действия пепсина:
1. 1,0-2,5
2. 1,8-3,0
3. 7,3-7,8
4. 3,5-4,7
33. Смысл переваривания белков в желудочно-кишечном тракте заключается:
1. В механическом измельчении пищевых белков
2. В расщеплении видоспецифических белков до видоспецифических аминокислот
3. В расщеплении видоспецифических белков до аминокислот, не обладающих видовой специфичностью
34. Активация пепсиногена и превращение его в активный пепсин происходит путём:
1. Ковалентной модификации
2. Аллостерической модуляции
3. Ограниченного избирательного протеолиза
4. Активации ионами металлов
35. Специфичность действия пепсина заключается в гидролитическом разрыве пептидных связей, образованных с участием:
1. Карбоксильных групп лизина и треонина
2. Аминогрупп фенилаланина и тирозина
3. Аминогрупп лизина и треонина
4. Карбоксильных групп фенилаланина и тирозина
5. Аминогрупп фенилаланина и триптофана
36. В результате действия пепсина на белки образуется:
1. Смесь полипептидов разной длины
2. Смесь полипептидов и отдельных аминокислот
3. Смесь различных аминокислот
37. Соляная кислота в желудке выполняет следующие функции:
1. Катализ превращения пепсиногена в пепсин
2. Кислотный гидролиз пищевых белков
3. Создание оптимального значения рН для действия пепсина
4. Бактерицидное действие
38. Каково значение нормальной концентрации HCl в желудочном соке взрослого человека:
1. 10-20 ммоль/л
2. 20-40 ммоль/л
3. 30-50 ммоль/л
4. 40-60 ммоль/л
39. Каково значение общей кислотности желудочного сока взрослого человека:
1. 10-20 ммоль/л
2. 20-40 ммоль/л
3. 30-50 ммоль/л
4. 40-60 ммоль/л
40. В расщеплении пищевых белков в кишечнике человека принимают участие ферменты:
1. Трипсин
2. Гастриксин
3. Коллагеназа
4. Аминопептидаза
5. Реннин
41. В расщеплении пищевых белков в кишечнике человека принимают участие ферменты:
1. Химотрипсин
2. Эластаза
3. Карбоксипептидаза
4. Пепсин
5. Аминопептидаза
42. Активация трипсиногена и превращение его в активный трипсин в просвете кишечника происходит путём:
1. Ковалентной модификации
2. Аллостерической модуляции
3. Активации ионами металлов
4. Избирательного ограниченного протеолиза
43. Оптимальное значение рН для действия трипсина:
1. 1,0-2,5
2. 1,0-3,0
3. 7,2-7,8
4. 3,5-4,6
44. Специфичность действия трипсина заключается в гидролитическом разрыве пептидных связей, образованных с участием:
1. Карбоксильных групп лизина и аргинина
2. Аминогрупп фенилаланина и тирозина
3. Аминогрупп лизина и треонина
4. Карбоксильных групп фенилаланина и тирозина
45. Специфичность действия аминопептидаз заключается в гидролитическом отщеплении:
1. Полипептида от срединной части молекулы белка
2. Аминокислоты с N-конца полипептидной цепи
3. Аминокислоты с С-конца полипептидной цепи
46. Специфичность действия карбоксипептидаз заключается в гидролитическом отщеплении:
1. Полипептида от срединной части молекулы белка
2. Аминокислоты с N-конца полипептидной цепи
3. Аминокислоты с С-конца полипептидной цепи
47. Всасывание аминокислот в стенку кишечника происходит по механизму:
1. Простой диффузии
2. Облегчённой диффузии
3. Активного транспорта
48. Подберите каждому проферменту соответствующий активатор:
1. Пепсиноген
2. Трипсиноген
3. Химотрипсиноген
4. Прокарбоксипептидаза
А. Бикарбонат натрия
Б. HCl
В. Трипсин
Г. Энтерокиназа
1Б 2Г 3В 4В
49. Среди субклеточных структур главная роль в обеспечении гидролиза белков принадлежит:
1. Митохондриям
2. Лизосомам
3. Аппарату Гольджи
4. Ядрышку
50. Аминокислотный пул организма это:
1. Общее количество свободных аминокислот крови
2. Общее количество свободных и связанных аминокислот в организме
3. Общее количество свободных кислот в организме
51. Аминокислотный пул среднестатистического человека составляет:
1. 10 г
2. 30 г
3. 100-120 г
4. 0,1 г
52. Пополнение аминокислотного пула организма происходит за счёт:
1. Всасывания аминокислот из кишечника
2. Распада тканевых белков
3. Синтеза аминокислот из продуктов окисления высших жирных кислот
4. Синтеза заменимых аминокислот
53. Аминокислоты из аминокислотного пула расходуются на:
1. Синтез пептидов и белков
2. Окислительный распад до конечных продуктов
3. Окисление в ходе гликолиза
4. Синтез низкомолекулярных органических соединений
5. Глюконеогенез
54. В норме ежесуточно расщепляется до конечных продуктов:
1. 70-100 г аминокислот
2. 170-200 г аминокислот
3. 100-150 г аминокислот
55. В норме ежесуточно на синтез белков в организме человека из аминокислотного пула расходуется:
1. 70-100 г аминокислот
2. 170-200 г аминокислот
3. 400 г аминокислот
56. Гормоны, стимулирующие использование аминокислот для синтеза белков в организме:
1. Инсулин
2. Адреналин
3. Тироксин
4. Соматотропин
5. Глюкагон
57. Гормоны, стимулирующие использование аминокислот для синтеза белков в организме:
1. Тестостерон
2. Инсулин
3. Кортизол
4. Соматотропин
5. Глюкагон
58. Расщепление белков в периферических тканях стимулируют:
1. Глюкагон
2. Кортизол
3. Минералокортикоиды
59. В результате гниения белков в кишечнике образуется:
1. Фенол
2. Аммиак
3. Пируват
4. Сероводород
5. Крезол
60. Обезвреживание индола в печени происходит в результате:
1. Включение индола в орнитиновый цикл
2. Связывания индола с ФАФС
3. Окисление индола с помощью монооксигеназной системы до индоксила и последующего взаимодействия с ФАФС
61. Обезвреживание фенола в печени происходит в результате:
1. Взаимодействия фенола с УДФ-глюкуроновой кислотой с образованием фенолглюкуроновой кислоты
2. Взаимодействия фенола с ФАФС с образованием фенолсерной кислоты
3. Окисления фенола с помощью монооксигеназной системы до индоксила и последующего взаимодействия с ФАФС
62. Повышение содержания индикана в моче свидетельствует:
1. О белковой недостаточности
2. Об активации процессов гниения белков в кишечнике
3. О нарушении детоксикационной функции печени
63. Функции процесса трансаминирования:
1. Участие в синтезе заменимых аминокислот
2. Депонирование аминокислот
3. Начальный этап катаболизма аминокислот
4. Начальный этап включения аминокислот в видоспецифические белки
64. Процесс трансдезаминирования более выгоден для клеток по сравнению с процессом прямого окислительного дезаминирования аминокислот по следующим причинам:
1. Скорость процесса выше
2. Скорость процесса ниже
3. Не образуется токсичной перекиси водорода
4. Не образуются восстановленные коферменты
5. Образуется НАДН + Н+
65. Процесс трансаминирования в организме человека выполняет следующие функции:
1. Синтез заменимых аминокислот
2. Путь катаболизма аминокислот
3. Способ связывания аммиака
66. Кетокислоты, образующиеся в ходе дезаминирования аминокислот используются по следующим направлениям:
1. Окислительный распад до СО2 и Н2О
2. Синтез биогенных аминов
3. Глюконеогенез
4. Синтез пуриновых нуклеотидов
5. Ресинтез аминокислот
67. Выберите правильные ответы. В реакциях трансаминирования участвует:
1. Аминокислота
2. Пиридоксальфосфат
3. Аммиак
4. Кетокислота
5. Аминотрансфераза
68. Из приведённого перечня уравнений реакций выберите реакцию, соответствующую внутримолекулярному дезаминированию:
1. 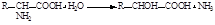
2. 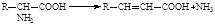
3. 
69. Из приведённого перечня уравнений реакций выберите реакцию, соответствующую прямому окислительному дезаминированию:
1. 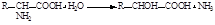
2. 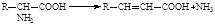
3. 
70. Нарушение трансаминирования происходит при недостатке витамина:
1. РР
2. В1
3. В6
4. В2
71. Дезаминирование аминокислот происходит путём:
1. Восстановительного дезаминирования
2. Перекисного дезаминирования
3. Гидролитического дезаминирования
4. Внутримолекулярного дезаминирования
5. Окислительного дезаминирования
72. Окислительное дезаминирование аминокислот в организме человека идёт с участием ферментов:
1. α-кетоглутаратдегидрогеназы
2. Глутаматдегидрогеназы
3. Оксидазы L-аминокислот
4. Моноаминоксидазы
73. Аминотрансферазы содержат кофермент:
1. НАД+
2. Пиридоксальфосфат
3. Тиаминпирофосфат
4. ФАД
74. Для непрямого окислительного дезаминирования необходимы витамины:
1. В1
2. В6
3. РР
4. С
75. Ингибиторами фермента глутаматдегидрогеназы в печени являются:
1. НАД+
2. АТФ
3. АДФ
4. НАДН + Н+
5. АМФ
76. Выберите правильные ответы. Глутамат:
1. Является универсальным донором аминогрупп в реакциях трансаминирования
2. Образуется из α-кетоглутарата
3. Дезаминируется НАД-зависимой глутаматдегидрогеназой
4. Является заменимой аминокислотой
5. Подвергается непрямому окислительному дезаминированию
77. Выберите процессы, в которых могут участвовать безазотистые остатки отдельных аминокислот:
1. Синтез заменимых аминокислот
2. Окислительный распад до СО2 и Н2О
3. Синтез глюкозы
4. Синтез полипептидов
5. Синтез кетоновых тел
78. Выберите глюкогенные аминокислоты:
1. Глутамат
2. Фенилаланин
3. Аланин
4. Лизин
5. Валин
79. К глюкогенным аминокислотам относятся:
1. Аланин
2. Пролин
3. Глутамат
4. Лейцин
5. Изолейцин
80. Кетокислоты используются в организме для:
1. Синтеза глюкозы
2. Синтеза биогенных аминов
3. Синтеза кетоновых тел
4. Синтеза аминокислот
81. При катаболизме кетогенных аминокислот образуется:
1. Пируват
2. Ацетил-СоА
3. α-кетоглутарат
4. Сукцинил-СоА
5. Фумарат
82. При катаболизме глюкогенных аминокислот образуется:
1. Пируват
2. Ацетил-СоА
3. α-кетоглутарат
4. Сукцинил-СоА
5. Фумарат
83. Кетогенными аминокислотами являются:
1. Лизин
2. Глутамат
3. Лейцин
4. Пролин
5. Метионин
84. Кетогенными аминокислотами являются:
1. Лизин
2. Глутамат
3. Лейцин
4. Пролин
5. Метионин
85. Гистамин выполняет в организме человека следующие функции:
1. Медиатор стволовой части мозга
2. Участвует в развитии воспалительной реакции
3. Промежуточный продукт при синтезе норадреналина и адреналина
4. Стимулирует выработку желудочного сока
5. Оказывает сосудорасширяющее действие
86. Адреналин выполняет в организме человека следующие функции:
1. Медиатор стволовой части мозга
2. Участвует в развитии воспалительной реакции
3. Оказывает сосудосуживающее действие
4. Стимулирует мобилизацию гликогена в печени
5. Оказывает сосудорасширяющее действие
87. Адреналин выполняет в организме человека следующие функции:
1. Стимулирует мобилизацию триглицеридов в жировой ткани
2. Участвует в развитии воспалительной реакции
3. Стимулирует гликогенолиз в мышцах
4. Стимулирует мобилизацию гликогена в печени
5. Оказывает сосудорасширяющее действие
88. Серотонин выполняет в организме человека следующие функции:
1. Медиатор стволовой части мозга
2. Тормозной медиатор ЦНС
3. Промежуточный продукт при синтезе адреналина и норадреналина
4. Оказывает сосудосуживающее действие
89. ГАМК выполняет в организме человека следующие функции:
1. Медиатор стволовой части мозга
2. Медиатор воспаления
3. Тормозной медиатор ЦНС
4. Оказывает сосудосуживающее действие
90. Инактивация биогенных аминов в организме происходит путём:
1. Окислительного дезаминирования
2. Восстановительного дезаминирования
3. Реакций конъюгации
4. Реакций декарбоксилирования
91. Подберите к каждому из указанных биогенных аминов аминокислоту, из которой он образуется:
1. Гистамин
2. γ-аминомасляная кислота
3. Серотонин
А. Серин
Б. Триптофан
В. Гистидин
Г. Глутамат
1В 2Г 3Б
92. При недостатке в организме витамина В9 в организме развивается анемия, т.к.:
1. Развивается белковая недостаточность
2. Нарушается синтез пуриновых и пиримидиновых нуклеотидов
3. Нарушаются химические реакции, связанные с переносом одноуглеродных фрагментов
4. Развивается гипоэнергетическое состояние
93. Сульфаниламидные препараты угнетают рост многих микроорганизмов, т.к.:
1. Нарушается синтез фолиевой кислоты в клетках микроорганизмов
2. Развивается белковая недостаточность
3. Нарушается синтез гетерополисахаридов
94. В процессе обмена аминокислот наиболее энергично протекает прямое окислительное дезаминирование:
1. Аланина
2. Аспарагиновой кислоты
3. Глутаминовой кислоты
4. Глицина
95. В реакции инактивации биогенных аминов принимают участие ферменты:
1. Декарбоксилаза
2. Моноаминоксидаза
3. Трансаминаза
4. Метилтрансфераза
96. Выберите из предложенных процессы обмена, которые будут нарушены при недостатке фолиевой кислоты:
1. Образование S-аденозилметионина
2. Синтез метионина из гомоцистеина
3. Синтез пуриновых нуклеотидов
4. Превращение серина в глицин
97. Какое количество аммиака образуется в сутки в организме человека массой 70 кг, в рационе которого содержится 70-100 г белков:
1. 2 г
2. 10 г
3. 17 г
4. 70 г
98. Окончательное обезвреживание аммиака происходит:
1. В печени
2. В кишечнике
3. В почках
4. В кровеносном русле
99. Образовавшийся в тканях аммиак переносится к местам окончательного обезвреживания аммиака в составе:
1. Аланина
2. Валина
3. Глутамина
4. Аспарагина
100. Ежесуточно в организме взрослого человека образуется следующее количество мочевины:
1. 10-15 г
2. 10-15 моль
3. 20-35 г
4. 20-35 моль
101. Нормальное содержание мочевины в крови взрослого человека:
1. 3,3 – 5,5 ммоль/л
2. 3,3 – 8,3 ммоль/л
3. 3,3 – 5,5 г/л
4. 3,3 – 8,3 г/100мл
102. Причины снижения содержания мочевины в суточном количестве мочи:
1. Недостаточное содержание белка в пищевом рационе
2. Тяжёлые поражения печени
3. Врождённая недостаточность фермента декарбоксилаз
4. Нарушение выделительной функции почек
103. Токсическое действие избытка аммиака в крови обусловлено:
1. Снижением содержания α-кетоглутарата в клетках
2. Подавлением обмена аминокислот
3. Воздействием на центральную нервную систему
4. Возникновением ацидоза
104. В обезвреживании аммиака участвуют:
1. СО2
2. Глутамат
3. Аланин
4. Глутамин
5. Аспартат
105. Установите соответствие:
Химические реакции
1. Синтез карбамоилфосфата с участием карбамоилфосфатсинтетазы I
2. Синтез глутамина
3. Образование солей аммония
4. Интенсивный синтез Аланина
Органы
А. Мышцы
Б. Печень
В. Оба органа
Г. Ни один
1Б 2В 3Г 4А
106. К конечным продуктам азотистого обмена относится:
1. Глутамин
2. Карнитин
3. Мочевина
4. Аланин
5. Аммонийные соли
107. Выберите один неправильный ответ. Мочевина:
1. Синтезируется в печени в реакциях орнитинового цикла
2. Экскретируется почками
3. Образуется в результате распада пуринового ядра нуклеотидов
108. Выберите из списка правильный вариант набора соединений, входящих в левую часть суммарного уравнения орнитинового цикла:
1. СО2, NH3, Н2О, аспартат
2. АТФ, СО2, NH3, Н2О аспартат
3. Мочевина, АДФ, АМФ, Н3РО4
4. Мочевина, АДФ, АМФ, фумарат, Н3РО4
109. Выберите из списка правильный вариант набора соединений, входящих в правую часть суммарного уравнения орнитинового цикла:
1. СО2, NH3, Н2О, аспартат
2. АТФ, СО2, NH3, Н2О аспартат
3. Мочевина, АДФ, АМФ, Н3РО4
4. Мочевина, АДФ, АМФ, фумарат, Н3РО4
110. Подберите правильное название соединению:
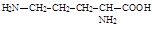
1. Цитруллин
2. Орнитин
3. Карбамоилфосфат
4. Мочевина
111. Подберите правильное название соединению:
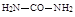
1. Цитруллин
2. Орнитин
3. Карбамоилфосфат
4. Мочевина
112. Сколько моль АТФ затрачивается на синтез 1 моль мочевины:
1. 1 АТФ
2. 2 АТФ
3. 3 АТФ
4. 4 АТФ
113. Выберите названия ферментов, катализирующих реакции орнитинового цикла:
1. Карбамоилфосфатсинтетаза
2. Аргининосукцинатлиаза
3. Глутаминсинтетаза
4. Аргиназа
5. Моноаминоксидаза
114. Выберите утверждение, которое нарушает последовательность событий при синтезе мочевины:
1. Молекула аммиака включается в карбамоилфосфат в митохондриях гепатоцитов
2. Аргинин распадается на орнитин и мочевину
3. Орнитин поступает в митохондрии и превращается в цитруллин
4. Молекула цитруллина транспортируется из митохондрии в цитоплазму
5. Цитруллин связывается с молекулой аспартата
115. Непосредственным источником атомов азота мочевины в орнитиновом цикле является:
1. Аммиак
2. Аланин
3. Глутамат
4. Аспартат
116. Реакции орнитинового цикла, идущие с затратой энергии АТФ катализирует:
1. Аргиназа
2. Орнитинкарбамоилтрансфераза
3. Карбамоилфосфатсинтетаза I
4. Аргининосукцинатсинтетаза
117. При гипераммониемии:
1. Снижается концентрация глутамина и аланина в крови
2. Увеличивается содержание аммиака в крови
3. Уменьшается выведение аммонийных солей
4. Развивается ацидоз
5. Увеличивается содержание глутамина и аланина в крови
118. Причиной развития гипераммониемии может быть:
1. Панкреатит
2. Тяжёлое поражение печени
3. Наследственные дефекты ферментов орнитинового цикла
119. Причины увеличения содержания мочевины в суточном количестве мочи:
1. Недостаточное содержание белка в пищевом рационе
2. Тяжёлые поражения печени
3. Преимущественно белковая диета
4. Нарушение выделительной функции почек
5. Патологические процессы сопровождающиеся распадом тканевых белков
120. Какое количество аммиака ежесуточно выделяется с мочой в виде солей аммония:
1. До 0,1 г
2. До 1 г
3. До 10 г
4. До 100 г
121. При развитии ацидоза выведение аммиака с мочой:
1. Увеличивается
2. Уменьшается
3. Не изменяется
122. Причины развития гипераммониемии следующие:
1. Тяжёлое поражение печени
2. Недостаточное содержание белка в пищевом рационе
3. Генетически обусловленный дефект синтеза одного из ферментов цикла мочевинообразования
4. Нарушение выделительной функции почек
123. Гипераммониемия - это:
1. Избыточное накопление в крови аминокислот
2. Избыточное накопление в крови аммиака
3. Избыточное выведение аминокислот с мочой
4. Избыточное выведение аммиака с мочой
124. Выберите процессы сопровождающиеся образованием аммиака в организме:
1. Дезаминирование аминокислот
2. Декарбоксилирование аминокислот
3. Дезаминирование АМФ
4. Реаминирование аминокислот
5. Инактивация биогенных аминов окислительным путём
125. У больного ребёнка, страдающего тошнотой, рвотой, судорогами, в особенности после приёма белковой пищи, в крови повышенно содержание аммиака и цитруллина. Недостаточность какого фермента приводит к развитию данного состояния:
1. Аргининосукцинатлиазы
2. Аргининосукцинатсинтетазы
3. Карбамоилфосфатсинтетазы
126. У больного ребёнка, страдающего тошнотой, рвотой, судорогами, в особенности после приёма белковой пищи, в крови повышенно содержание аммиака, аргинина и цитруллина. Недостаточность какого фермента приводит к развитию данного состояния:
1. Аргининосукцинатлиазы
2. Аргининосукцинатсинтетазы
3. Карбамоилфосфатсинтетазы
4. Аргиназы
127. У больного ребёнка, страдающего тошнотой, рвотой, судорогами, в особенности после приёма белковой пищи, в крови повышенно содержание аммиака, аргининосукцината и цитруллина. Недостаточность какого фермента приводит к развитию данного состояния:
1. Аргининосукцинатлиазы
2. Аргининосукцинатсинтетазы
3. Карбамоилфосфатсинтетазы
4. Аргиназы
128. К аргининосукцинатурии приводит дефект фермента:
1. Карбамоилфосфатсинтетазы
2. Орнитинкарбамоилтрансферазы
3. Аргининосукцинатлиазы
4. Аргининосукцинатсинтетазы
129. Установите соответствие:
Дефект фермента:
1. Аргининосукцинатсинтетазы
2. Карбамоилсинтетазы I
3. Аргиназы
Патология:
А. Гипераммониемия
Б. Цитруллинемия
В. Гипераргининемия
1Б 2А 3В
130. Глутамин:
1. Подвергается расщеплению глутаминазой почек при ацидозе
2. Является формой выведения аммиака из тканей
3. Экскретируется почками как конечный продукт катаболизма аминокислот
4. Используется в качестве нейромедиатора в нервной системе
131. Развитие белковой недостаточности может быть вызвано:
1. Недостаточным количеством белка в рационе
2. Нарушением процессов обезвреживания аммиака
3. Недостатком незаменимых аминокислот в белках пищи
4. Нарушением процессов переваривания белков в ЖКТ
132. При недостатке в организме витамина С нарушается процесс синтеза следующих белков:
1. Эластина
2. Кератина
3. Коллагена
133. Нарушение синтеза коллагена, при недостатке в организме витамина С происходит вследствие:
1. Нарушения процесса дезаминирования Пролина и Лизина
2. Нарушения процесса гидроксилирования остатков Пролина в составе полипептидных цепей тропоколлагена
3. Нарушения синтеза коллагена на рибосомах
134. При недостатке в организме витамина В6, нарушается обмен аминокислот вследствие:
1. Нарушения процессов всасывания аминокислот в кишечнике
2. Недостатка образования кофермента фосфопиридоксаля
3. Нарушения работы орнитинового цикла
135. Аминоацидурия - это:
1. Избыточное накопление в крови аминокислот
2. Избыточное накопление в крови аммиака
3. Избыточное выведение аминокислот с мочой
4. Избыточное выведение аммиака с мочой
136. Аминоацидурия может развиться вследствие:
1. Повышения содержания отдельных аминокислот в крови
2. Нарушении процессов дезаминирования аминокислот
3. Нарушения процессов реабсорбции аминокислот в почечных канальцах
137. Укажите, врождённая недостаточность какого фермента сопровождается развитием алкаптонурии:
1. Оксидазы гомогентизиновой кислоты
2. Фенилаланингидроксилазы
3. Гистидазы
138. Укажите, врождённая недостаточность какого фермента сопровождается развитием фенилкетонурии:
1. Оксидазы гомогентизиновой кислоты
2. Фенилаланингидроксилазы
3. Гистидазы
139. При врождённой недостаточности фермента фенилаланингидроксилазы в крови накапливается:
1. Фенилаланин
2. Тирозин
3. Фенилпируват
4. Фенилбутират
5. Фенилацетат
140. Определение активности аминотрансфераз используется в медицине для:
1. Диагностики заболеваний различных органов, сопровождающихся деструкцией клеток
2. Для диагностики заболеваний печени
3. Для диагностики заболеваний кишечника
4. Для диагностики поражений миокарда
Пациенту с острыми болями в области сердца определили активность аминотрансфераз в крови. Активность какой из аминотрансфераз в наибольшей степени увеличивается при этой патологии?
1. Аспартатаминотрансферазы
2. Аланинаминотрансферазы
3. Лейцинаминотрансферазы
142. Укажите, дефект какого из ферментов орнитинового цикла приводит к развитию заболевания аргининосукцинатурии, при котором суточная экскреция аргининосукцината значительно увеличивается:
1. Аргининосукцинатсинтетазы
2. Аргининосукцинатлиазы
3. Карбамоилфосфатсинтетазы
143. Выберите реакции и компоненты, характерные для процессов прямого окислительного дезаминирования L-аминокислот:
1. Трансаминирование с α-кетоглутаратом
2. Дезаминирование глутаминовой кислоты
3. Трансаминирование с оксалоацетатом
4. Участвует ФМН
5. Участвует НАД+
6. Процесс сопряжён с образованием Н2О2
144. Выберите реакции и компоненты, характерные для процессов непрямого окислительного дезаминирования L-аминокислот:
1. Трансаминирование с α-кетоглутаратом
2. Дезаминирование глутаминовой кислоты
3. Трансаминирование с оксалоацетатом
4. Участвует фосфопиридоксаль
5. Участвует НАД+
6. Процесс сопряжён образованием Н2О2
7. Процесс связан с трансаминированием
145. Подберите к пронумерованным реакциям обезвреживания аммиака соответствующий фермент:
1. Глу + NH3 + АТФ → Глн + АДФ + Ф
2. α-кетоглутарат + NH3 + НАДН+Н+ → Глу + НАД+ + Н2О
3. СО2 + NH3 + 2 АТФ → Карбамоилфосфат + 2 АДФ + Ф
А. Глутаминаза
Б. Глутаминсинтетаза
В. Глутаматдегидрогеназа
Г. Карбамоилфосфатсинтетаза
1Б 2В 3Г
146. Подберите ферментам, участвующим в обмене аминокислот, соответствующие коферменты:
1. Декарбоксилазы
2. Аминотрансферазы
3. Глутаматдегидрогеназа
4. Моноаминоксидаза
А. ФАД
Б. НАД+
В. Фосфопиридоксаль
Г. Тиаминпирофосфат
1В 2В 3Б 4А
147. Подберите к данной реакции орнитинового цикла недостающий компонент:
? + аспартат → аргининосукцинат
1. Цитруллин
2. Фумарат
3. Аргинин
148. Подберите к данной реакции орнитинового цикла недостающий компонент:
аргинин → мочевина +
1. Орнитин
2. Аргинин
3. Фумарат
149. Подберите к данной реакции орнитинового цикла недостающий компонент:
орнитин + карбамоилфосфат →?
1. Аргинин
2. Цитруллин
3. Фумарат
150. Подберите к данной реакции орнитинового цикла недостающий компонент:
аргининосукцинат → аргинин +?
1. Цитруллин
2. Орнитин
3. Фумарат
151. К процессу трансаминирования относятся следующие утверждения:
1. Является этапом катаболизма
2. Мож