Системы с ограниченной растворимостью компонентов
Друг в друге в кристаллическом состоянии.
Промежуточное положение между диаграммами относящимися к двум предельным случаям полной нерастворимости и полной растворимости компонентов друг в друге в кристаллическом состоянии занимают диаграммы чрезвычайно распространенных в природе систем (Bi – Pb, Cu – Al, CaO – MgO и многие другие), у которых в твердом состоянии компонент B до определенной концентрации растворяется в компоненте A, образуя твердый раствор, обозначаемый далее как α–раствор, а компонент A до определенной концентрации растворим в B, образуя твердый раствор, обозначаемый как
β–раствор (рис 21.1).
Сопоставляя эту, на первый взгляд сложную, разделенную на шесть зон диаграмму с диаграммами, рассмотренными ранее, нетрудно убедиться, что она сочетает в себе геометрические элементы диаграмм, представленных ранее в предыдущих лекциях.
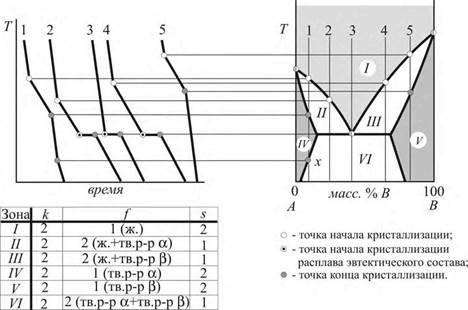
Рис. 21.1. Система с ограниченной растворимостью компонентов друг в друге в кристаллическом состоянии.
Ход кривых охлаждения 1 и 5 в областях низких концентраций каждого из компонентов аналогичен ходу кривых для диаграммы с полной растворимостью компонентов (рис.3.10), а в той области, которая соответствует горизонтальному участку линии солидуса (кривые 2, 3 и 4), – ходу кривых для диаграмм с полной нерастворимостью компонентов друг в друге (3.6) (но в зоне VI твердые фазы представляют собой не кристаллы чистых веществ, а кристаллы твердых растворов α и β).
Отличие в ходе кривой охлаждения 1 на рис. 21.1 от кривой 2 на рис. 3.10 заключается только в том, что образовавшийся твердый раствор α при дальнейшем охлаждении системы достигает насыщения (точка х) и распадается на две фазы α и β (переход из зоны IV в зону VI, где f = 2 и c = 1). Однако тепловой эффект такого перехода обычно невелик и соответствующий перегиб на кривой охлаждения выражен не так четко, как точка начала кристаллизации.
Системы, образующие химические соединения
Иногда в результате химических реакций между веществами образуются химические соединения. Эти соединения обладают различной термической устойчивостью.
К устойчивым относят такие соединения, которые плавятся без разложения, или с частичной диссоциацией, но без изменения состава. В этом случае состав расплава совпадает с составом химического соединения (конгруэнтноеплавление).
К неустойчивым относят такие соединения, температура разложения которых ниже гипотетической температуры их плавления. При нагревании они разлагаются и образуют кристаллы и расплав различного состава, отличающегося от состава химического соединения (инконгруэнтное плавление).
Системы, образующие устойчивые химические соединения
Диаграмма плавкости веществ, образующих два конгруэнтно плавящихся соединения С и D показана на рис. 21.2. Её можно рассматривать как сомкнутые по ординатам три диаграммы плавкости систем, неограниченно растворимых в жидком и не растворимых друг в друге в кристаллическом состоянии.
Молекулярную формулу образующихся химических соединений можно определить по положению точек С и D. Если МB и Ма - молярные массы, а ωB и ωA - массовые доли компонентов В и А в химическом соединении АХВУ, то
 =
= 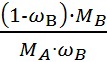 . (21.1)
. (21.1)

Рис. 21.2. Система, образующая химические соединения в кристаллическом состоянии.
Если фигуративная точка лежит на ординате Cc 0 или Dd 0, то система содержит только один компонент – химическое соединение состава C или D. Точки c 0 и d 0 соответствуют температурам плавления химических соединений и называются дистектическими точками.
Острый максимум (точка c 0) соответствует не диссоциирующему химическому соединению, а плавный максимум (точка d 0) – соединению, частично диссоциирующему при плавлении. Кривая охлаждения расплава, состав которого совпадает с составом химического соединения, имеет вид, аналогичный кривой охлаждения чистого соединения (рис. 21.2, кривые C и D). Для других составов кривые охлаждения (например, 1 и 2) аналогичны кривым на рис. 3.6. В остальном анализ диаграммы, показанной на рис. 21.2, ничем не отличается от анализа диаграммы, показанной на рис. 3.6.