Институт металлургии и химии

Кафедра химии
Практические занятия по теме
«Химическая кинетика и химическое равновесие»
По дисциплине «Химия»
Учебно-методическое пособие
ЧЕРЕПОВЕЦ
Практические занятия по теме «Химическая кинетика и химическое равновесие» по дисциплине «Химия». Учебно-методическое пособие к практическим занятиям по дисциплине «Химия». Череповец: ЧГУ, 2002. с. 23.
Пособие включает в себя основные теоретические аспекты, примеры решения типовых задач и контрольные задания по теме «Химическая кинетика и химическое равновесие» курса химии. Содержание учебно-методического пособия соответствует государственному стандарту дисциплины «Химия» для химических и инженерно-технических специальностей.
Рассмотрено на заседании кафедры химии, протокол № 9 от 31.05.2002 г.
Одобрено редакционно-издательской комиссией Института металлургии и химии ЧГУ, протокол № 5 от 03.06.2002 г.
Составитель: О.А. Калько – канд. техн. наук, доцент
Рецензенты: В.А. Котенко, канд. техн. наук, доцент (ЧГУ);
Г.В. Козлова, канд. хим. наук, доцент (ЧГУ)
Научный редактор: О.А. Калько – канд. техн. наук, доцент
© Череповецкий государственный
университет, 2001
ХИМИЧЕСКАЯ КИНЕТИКА
Скорость химических реакций
Химическая кинетика изучает механизм и скорость протекания химических реакций. В зависимости от типа системы различают гомогенные реакции (протекают с одинаковой скоростью по всему объему) и гетерогенные реакции (идут на поверхности раздела фаз, так как только там имеется физический контакт между веществами).
Скоростью реакции называют изменение объемной (для гомогенных реакций) или поверхностной (для гетерогенных реакций) концентрации исходного вещества или продукта реакции в единицу времени. Различают среднюю и мгновенную скорости реакции.
Средняя скорость реакции `u равна:
`u = 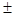
 =
= 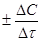 ,
,
где С 1 – концентрация вещества в начальный момент времени t1; С 2 – концентрация вещества в конечный момент времени t2. Знак минус относится к концентрации исходного вещества, а знак плюс – к концентрации продукта.
Скорость реакции в данный момент времени, иначе мгновенная скорость реакции u, равна:
u =  ,
,
где d С – дифференциально-малое изменение концентрации за дифференциально-малый промежуток времени dt.
Из определения скорости реакции следует, что скорость гомогенной реакции имеет единицы измерения  , а гетерогенной -
, а гетерогенной -  .
.
В ходе реакции нет необходимости следить за концентрациями всех участников реакции, так как стехиометрическое уравнение устанавливает соотношение между концентрациями всех реагентов. Так, для гомогенной реакции общего вида а А + b В ® d D + m M скорости изменения концентраций реагентов связаны между собой соотношением:
 .
.
Скорость реакции зависит от многих факторов: природы взаимодействующих веществ, концентрации реагентов, температуры, присутствия в системе катализатора и др.
Зависимость скорости реакции от концентраций реагентов устанавливает основной закон химической кинетики: при постоянной температуре мгновенная скорость реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях своих частных порядков реакции. Математическая запись закона для гомогенной реакции а А + b В ® продукты будет отражаться уравнением:
u = k ×[А] 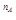 ×[В]
×[В]  ,
,
где k – константа скорости реакции; [А], [В] – концентрации реагентов; n А, n В – порядок реакции по веществам А и В соответственно. Математическая запись закона действующих масс иначе называется кинетическим уравнением реакции. Для гетерогенных систем в кинетическое уравнение реакции не включают концентрации твердых реагентов, так как в ходе процесса они практически не изменяются.
Константа скорости реакции зависит от тех же факторов, что и скорость реакции, кроме концентраций веществ. Константа скорости реакции численно равна скорости реакции, когда концентрации реагентов одинаковые и равны единице. Единицы измерения k зависят от порядка реакции.
Порядком реакции n называют сумму показателей степеней при концентрациях в кинетическом уравнении реакции. Например, для реакции а А + b В ® продукты порядок реакции равен
n = n А + n В.
Из данного уравнения ясно, что общий порядок реакции равен сумме частных порядков реакции по реагентам. Теоретически определить порядок реакции сложно, поэтому его определяют экспериментально.
По механизму взаимодействия реакции делят на простые и сложные. Простые – это реакции, протекающие необратимо в одну стадию, при этом уравнение реакции полностью отражает механизм взаимодействия веществ. Все остальные реакции являются сложными. Для простых реакций n равен сумме стехиометрических коэффициентов в уравнении реакции. Например, если реакция а А + b В ® продукты простая, то кинетическое уравнение данной реакции имеет вид:
u = k ×[А] а ×[В] b.
Для простых реакций основной закон химической кинетики называется законом действующих масс.
Все гетерогенные и многие гомогенные реакции являются сложными. В этом случае закон действующих масс выполняется для каждой стадии отдельно, а общая скорость процесса будет равна наиболее медленной стадии, которую называют лимитирующей.
Пример 1. Для простой реакции А + 2В® D начальные концентрации А и В равны 0,03 и 0,05 моль/дм3. константа скорости реакции равна 0,4  . Вычислите начальную скорость реакции и скорость реакции, когда концентрация вещества А уменьшится на 0,01 моль/дм3.
. Вычислите начальную скорость реакции и скорость реакции, когда концентрация вещества А уменьшится на 0,01 моль/дм3.
Р е ш е н и е
Запишем кинетическое уравнение данной реакции
u = k ×[A]×[B]2.
Тогда скорость реакции в начальный момент времени равна
u = 0,4×0,03×(0,05)2 = 3×10-5  .
.
Определим концентрации реагентов, когда концентрация А уменьшится на 0,01 моль/дм3. Концентрация вещества А будет равна разности между начальным значением и израсходованным
[A] = 0,03 – 0,01 = 0,02 моль/дм3.
Согласно уравнению реакции расход по веществу В в два раза больше относительно вещества А, поэтому
[B] = 0,05 - 2×0,01 = 0,03 моль/дм3.
Вычисляем скорость реакции
u = 0,4×0,02×(0,03)2 = 7,2×10-6  .
.
Пример 2. Вычислите среднюю скорость реакции А + В = 3D, если начальная концентрация вещества А составляла 0,42 моль/дм3, а через 10 секунд стала равной 0,32 моль/дм3. Как изменяться за это время концентрации веществ В и D?
Р е ш е н и е
По условию задачи изменение концентрации вещества А за Dt = 10 с составило D С А = 0,32 – 0,42 = -0,1 моль/дм3. Следовательно, средняя скорость реакции
`u =  .
.
Поскольку на 1 моль вещества А, согласно уравнению реакции, расходуется 1 моль вещества В, то концентрация вещества В также уменьшилась на 0,01 моль/дм3, то есть D С В = -0,01 моль/дм3. Вещества D образуется в три раза больше, чем расходуется вещества А или В. Таким образом, концентрация вещества D за 10 секунд увеличилась на 0,03 моль/дм3 или D С D = 0,03 моль/дм3.
Пример 3. Как изменится скорость реакции 2NO + O2 = 2NO2, если при постоянной температуре повысить общее давление в системе в 2 раза?
Р е ш е н и е
Поскольку все участники реакции являются газообразными веществами, то увеличение общего давления в 2 раза при постоянной температуре вызовет уменьшение объема системы в 2 раза, то есть концентрация каждого из веществ увеличится в 2 раза. Согласно закону действующих масс скорость реакции до повышения давления равна
u1 = k ×[NO]2×[O2],
а после повышения давления
u2 = k ×(2[NO])2×2[O2] = 8 k ×[NO]2×[O2].
Так как константа скорости реакции не зависит от концентраций реагентов, то  , то есть, при повышении давления в 2 раза скорость данной реакции увеличится в 8 раз.
, то есть, при повышении давления в 2 раза скорость данной реакции увеличится в 8 раз.
Пример 4. Для реакции а А + в В + d D® продукты при повышении концентрации вещества А в 2 раза скорость реакции возрастает в 8 раз, при увеличении концентрации В в 3 раза скорость реакции не изменяется, а при повышении концентрации D в 4 раза скорость реакции увеличивается в 4 раза. Запишите кинетическое уравнение реакции.
Р е ш е н и е
Согласно основному закону химической кинетики скорость реакции
u = k ×[A] 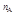 ×[B]
×[B]  ×[D]
×[D]  .
.
При постоянных концентрация В и D соотношение скоростей реакции при изменении концентрации вещества А будет равно
 .
.
По условию задачи если [A]2 = 2[A]1, то есть  . Тогда решаем уравнение
. Тогда решаем уравнение
 или n А = 3.
или n А = 3.
По аналогии определяем, что n В = 0, а n D = 1. Таким образом, кинетическое уравнение данной реакции имеет вид
u = k ×[A]3×[B]0×[D]1.
З а д а ч и
1. Начальные концентрации реагирующих веществ реакции
СО + Н2Огаз = СО2 + Н2
были равны (моль/дм3): [CO] = 0,8; [H2O] = 0,9; [CO2] = 0,7; [H2] = 0,5. Определите концентрации всех участников реакции, после того как прореагирует 75 % монооксида углерода.
2. Константа скорости реакции А + 2В® 3D равна 0,6  . Начальные концентрации веществ А и В равны 5 и 4 моль/дм3 соответственно. Вычислите скорость реакции, когда концентрация вещества D достигнет 1,5 моль/дм3.
. Начальные концентрации веществ А и В равны 5 и 4 моль/дм3 соответственно. Вычислите скорость реакции, когда концентрация вещества D достигнет 1,5 моль/дм3.
3. Определите, во сколько раз изменится скорость гомогенной газовой реакции 4HCl + O2 ® 2H2O + 2Cl2, если общее давление в системе увеличить в 3 раза.
4. Как изменятся скорости реакций, если объем каждой из систем уменьшить в 4 раза:
1) Sтв + О2 ® SO2, тв;
2) 2SO2, газ + О2 ® 2SO3, газ.
5. Две реакции между простыми веществами протекают с такой скоростью, что за 1 минуту образуется в первой реакции 6 г сероводорода, а во второй реакции 20 г йодоводорода. В каком случае средняя скорость реакции больше?
6. Константа скорости реакции А + 2В ® 2D равна 1,3  Определите начальную скорость реакции, если к некоторому моменту времени концентрации веществ А, В и D оказались равными 0,2; 0,1 и 0,5 моль/дм3 соответственно.
Определите начальную скорость реакции, если к некоторому моменту времени концентрации веществ А, В и D оказались равными 0,2; 0,1 и 0,5 моль/дм3 соответственно.
7. Реакция идет по уравнению 2NO + O2 ® 2NO2. Начальные концентрации NO и О2 были равны 0,8 и 0,6 моль/дм3. Во сколько раз изменится скорость реакции, если концентрацию кислорода увеличить до 0,9 моль/дм3, а концентрацию оксида азота повысить на 0,4 моль/дм3.
8. Константа скорости реакции 2N2O ® O2 + 2N2 равна 5×10-5  . Начальная концентрация реагента равна 3,2 моль/дм3. Определите скорость реакции, когда разложится 25 % исходного вещества.
. Начальная концентрация реагента равна 3,2 моль/дм3. Определите скорость реакции, когда разложится 25 % исходного вещества.
9. Во сколько раз следует увеличить концентрацию СО в системе, чтобы повысить скорость реакции 2СО ® СО2 + Ств в 4 раза?
10. Как изменится скорость реакции 2NO + Cl2 ® 2NOCl при увеличении концентрации оксида азота в 2 раза и при увеличении концентраций обоих компонентов в 3 раза?
11. Константа скорости реакции получения йодоводорода из простых веществ равна 0,16  . Исходные концентрации йода и водорода равны 0,04 и 0,05 моль/дм3 соответственно. Определите скорость реакции в момент времени, когда израсходуется половина водорода.
. Исходные концентрации йода и водорода равны 0,04 и 0,05 моль/дм3 соответственно. Определите скорость реакции в момент времени, когда израсходуется половина водорода.
12. Изучается скорость реакции взаимодействия веществ А и В. При постоянной концентрации А увеличение концентрации В в 3 раза приводит к повышению скорости реакции в 9 раз. При повышении концентраций обоих компонентов в 2 раза скорость реакции увеличивается в 16 раз. Запишите кинетическое уравнение реакции.
13. Скорость реакции 2NO + O2 ® 2NO2 при концентрациях NO и О2 равных 0,6 моль/дм3 составляет 0,018  . Вычислите константу скорости реакции.
. Вычислите константу скорости реакции.
14. Кинетическое уравнение реакции 4Н2 + 2NO2 ® 4H2O + N2 имеет вид
u = k ×[H2]×[NO2]2.
Определите общий порядок реакции и укажите, какая это реакция (простая или сложная).
15. Во сколько раз увеличится скорость реакции 2О3 ® 3О2 при увеличении общего давления в системе в 2 раза, если данная реакция является сложной и протекает через стадии:
1) О3 ® О2 + О (быстрая);
2) О + О3 ® 2О2 (медленная).
16. Во сколько раз увеличится скорость гомогенной газовой реакции между веществами А, В и D при повышении давления в 2 раза, если при изучении кинетики данной реакции были получены следующие сведения:
1) при повышении концентрации А в 4 раза скорость реакции возрастает в 4 раза;
2) при повышении концентрации В в 3 раза скорость реакции увеличивается в 27 раз;
3) при повышении концентрации D в 2 раза скорость реакции не изменяется.
17. Как изменится скорость реакции разложения карбоната кальция на оксид кальция и СО при уменьшении общего давления в 4 раза?
18. Реакция идет по уравнению N2 + O2 ® 2NO. Исходные концентрации азота и кислорода равны 0,049 и 0,01 моль/дм3. Вычислите концентрации веществ, когда в системе образуется 0,005 моль NO.
19. Вычислите среднюю скорость реакции I2 + H2 ® 2HI, если в системе объемом 2 литра за 15 минут образовалось 0,12 г йодоводорода.
20. В какой из систем при повышении давления скорость реакции возрастет в большее число раз:
1) N2 + O2 ® 2NO;
2) 2NO + O2 ® 2NO2.
21. Константа скорости реакции 2NO + O2 ® 2NО2 равна 5×10-5 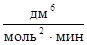 . Начальные концентрации реагентов одинаковые и равны 0,2 моль/дм3. Определите скорость реакции, когда разложится 25 % кислорода.
. Начальные концентрации реагентов одинаковые и равны 0,2 моль/дм3. Определите скорость реакции, когда разложится 25 % кислорода.
22. Изучается скорость реакции взаимодействия веществ А, В и D. При постоянных концентрациях А и D увеличение концентрации В в 3 раза приводит к повышению скорости реакции в 9 раз. При увеличении концентрации D в 2 раза скорость реакции не изменяется. При повышении концентраций каждого из компонентов в 2 раза скорость реакции увеличивается в 16 раз. Запишите кинетическое уравнение реакции.
23. Начальные концентрации реагирующих веществ реакции
СО + Н2Огаз ® СО2 + Н2
были равны (моль/дм3): [CO] = 0,8; [H2O] = 0,9; [CO2] = 0,7; [H2] = 0,5. Определите концентрации всех участников реакции, после того как концентрация водорода увеличится на 10 %.
24. Как изменится скорость реакции 2NO + Cl2 ® 2NOCl при увеличении концентрации оксида азота в 3 раза и при увеличении общего объема системы в 3 раза?
25. Две реакции между простыми веществами протекают с такой скоростью, что за 10 минут образуется в первой реакции 6 г СО, а во второй реакции 12 г СО2. В каком случае средняя скорость реакции больше?