Повышение температуры ускоряет большинство химических реакций. Приближенно влияние температуры на скорость реакции описывает эмпирическое правило Вант-Гоффа: при повышении температуры на 10 К скорость большинства реакций увеличивается в 2¸4 раза
u2 = u1×  ,
,
где u1, u2 – скорости реакции при температурах Т 1 и Т 2; g - температурный коэффициент Вант-Гоффа, который показывает во сколько раз увеличивается скорость реакции при повышении температуры на 10 К.
Для многих реакций в интервале температур от комнатных значений до 400 °С температурный коэффициент лежит в пределах от 2 до 4. Точнее значение g можно вычислить по формуле
 ,
,
где k 1, k 2 – константы скорости реакции при температурах Т 1 и Т 2.
Более строгая зависимость скорости реакции от температуры описывается уравнением Аррениуса
k =k0 ×  ,
,
где k – константа скорости реакции при температуре Т; k 0 – предэкспоненциальный множитель; е – основание натурального логарифма; Е А – энергия активации, Дж/моль; R – универсальная газовая постоянная.
Энергией активации называют избыток энергии, которым должны обладать молекулы, по сравнению со средним значением энергии частиц в системе, чтобы их столкновение привело к образованию продуктов реакции. Величина энергии активации зависит от природы реагирующих веществ. Для химических реакций значения Е А лежат в пределах 40¸400 кДж/моль. В узком интервале температур энергия активации практически не зависит от температуры и может быть вычислена по формуле
Е А =  ,
,
где Т 1, Т 2 – абсолютные значения температур, К; k 1, k 2 – значения констант скоростей реакции при данных температурах.
Для ускорения очень медленно протекающих химических реакций применяют катализаторы – вещества, способные понижать энергию активации реакции, ослабляя связи между молекулами. При этом молекулы становятся реакционно-способными при более низких температурах. Изменение скорости реакции путем добавления небольших порций катализатора называют катализом. Увеличение скорости реакции в присутствии катализатора можно оценить по уравнению
 ,
,
где uкат, k кат – скорость и константа скорости реакции в присутствии катализатора; u, k –скорость и константа скорости реакции без катализатора; Е А, кат, Е А – энергия активации реакции в присутствии катализатора и без него.
Пример 1. При 150 °С реакция заканчивается за 16 минут. Определите время, необходимое для протекания реакции при 200 °С, если температурный коэффициент Вант-Гоффа равен 2,5.
Р е ш е н и е
Между скоростью протекания химической реакции и ее продолжитель-ностью существует обратно пропорциональная зависимость
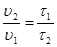 ,
,
тогда правило Вант-Гоффа в данном случае можно записать в виде
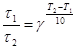 , откуда
, откуда 
 мин.
мин.
Пример 2. Вычислите энергию активации реакции, если при повышении температуры от 290 К до 300 К скорость реакции увеличивается в 2 раза.
Р е ш е н и е
Согласно основному закону химической кинетики, скорость реакции и константа скорости реакции прямо пропорциональны друг другу, то есть выполняется соотношение
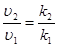
 .
.
Подставим это в формулу для расчета энергии активации
Е А =  Дж/моль.
Дж/моль.
Пример 3. Определите, на какую величину произошло снижение энергии активации при введении в систему катализатора, если при температуре 450 К в присутствии катализатора скорость реакции увеличилась в 1000 раз.
Р е ш е н и е
Преобразуем уравнение  к виду
к виду
(Е А, кат – Е А) = R×T ×ln 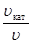 .
.
По условию задачи 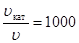 , тогда
, тогда
(Е А, кат – Е А) = 8,314 × 450 × ln1000 = 25844 Дж/моль.
З а д а ч и
1. На сколько градусов нужно повысить температуру, чтобы повысить скорость реакции в 64 раза, если температурный коэффициент реакции равен 2?
2. Скорость реакции при 40 °С равна 1  . Вычислите скорость этой реакции при 80 °С, если температурный коэффициент реакции равен 4.
. Вычислите скорость этой реакции при 80 °С, если температурный коэффициент реакции равен 4.
3. При повышении температуры на 50 К скорость реакции возросла в 1024 раза. Вычислите температурный коэффициент Вант-Гоффа.
4. Во сколько раз уменьшится скорость реакции, если температуру понизить от 140 до 110 °С. Температурный коэффициент скорости реакции принять равным 3.
5. Две реакции при 283 К протекают с одинаковой скоростью. Температурный коэффициент первой реакции равен 2,5, а второй – 3,0. Найдите соотношение скоростей данных реакций при температуре 350 К.
6. Вычислите, при какой температуре реакция закончится за 45 минут, если при 293 К на это требуется 3 часа. Температурный коэффициент скорости реакции принять равным 3,2.
7. На сколько градусов нужно повысить температуру, чтобы увеличить константу скорости реакции в 90 раз, если температурный коэффициент равен 2,7?
8. Вычислите константу скорости реакции при 680 К, если при 630 К константа скорости данной реакции равна 8,9×10-5  , а g = 2.
, а g = 2.
9. Константа скорости некоторой реакции при 273 К и 298 К равна соответственно 1,17 и 6,56  . Найдите температурный коэффициент скорости реакции.
. Найдите температурный коэффициент скорости реакции.
10. Вычислите энергию активации реакции, если константа скорости реакции при 600 К равна 83,9  , а при 640 она составляет 407
, а при 640 она составляет 407  .
.
11. Энергия активации реакции равна 186,4 кДж/моль. Вычислите константу скорости реакции при 700 К, если константа скорости данной реакции при 450 К равна 0,942×10-6  .
.
12. Константа скорости реакции при 1173 К равна 2,18×10-4 с-1. Определите константу скорости реакции в присутствии катализатора, который понижает энергию активации реакции на 20 кДж/моль.
13. Константа скорости реакции при 340 К равна 0,31 мин-1. Введение катализатора понижает энергию активации данной реакции на 95 кДж/моль. Определите константу скорости реакции в присутствии катализатора.
14. Энергия активации реакции равна 105 кДж/моль. При 300 К введение в систему катализатора ускоряет процесс в 10000 раз. Определите энергию активации реакции в присутствии катализатора.
15. Во сколько раз увеличится скорость растворения железа в 5 % мас. растворе соляной кислоты при повышении температуры на 58 К, если температурный коэффициент скорости реакции равен 2,8?
16. При 393 К реакция заканчивается за 18 минут. Через сколько времени эта реакция закончится при 453 К, если температурный коэффициент скорости реакции равен 3?
17. Определите температурный коэффициент скорости реакции, если при понижении температуры на 45 К реакция замедлилась в 25 раз.
18. Константы скорости реакции при 288 и 325 К соответственно равны 0,02 и 0,38 с-1. Определите температурный коэффициент скорости реакции и константу скорости реакции при температуре 303 К.
19. Энергия активации реакции равна 103,5 кДж/моль. При 298 К константа скорости данной реакции равна 0,00203 с-1. Вычислите константу скорости при температуре 288 К.
20. Константы скорости реакции при 283 и 293 К равны 2,15 и 4,23  . При введении в систему катализатора скорость реакции возрастает в 25000 раз. Определите энергию активации реакции в присутствии катализатора при 293 К.
. При введении в систему катализатора скорость реакции возрастает в 25000 раз. Определите энергию активации реакции в присутствии катализатора при 293 К.
21. Две реакции при температуре 293 К протекают с одинаковой скоростью. Температурный коэффициент первой реакции равен 2, а второй 4. Найдите соотношение скоростей данных реакций при температуре 500 К.
22. Константа скорости реакции при 298 К равна 9,67×10-3  , а при 40 °С - 73,4×10-3
, а при 40 °С - 73,4×10-3  . Определите константу скорости реакции при 310 К.
. Определите константу скорости реакции при 310 К.
23. Константа скорости реакции при 9,4 °С равна 2,37 мин-1, а при 14,4 °С составляет 3,204 мин-1. Вычислите энергию активации и температурный коэффициент скорости реакции.
24. Вычислите на сколько градусов необходимо повысить температуру, чтобы скорость реакции увеличилась в 50 и 100 раз. Если температурный коэффициент скорости реакции равен 3.
25. При 378 К за 363 минут разлагается 50 % исходного количества вещества. Определите время, необходимое для разложения 50 % данного вещества при 450 К, если энергия активации равна 217 кДж/моль.
ХИМИЧЕСКОЕ РАВНОВЕСИЕ