К этому классу относят коллаген VI типа, который является короткоцепочечным белком. Он образует микрофибриллы, которые располагаются между крупными фибриллами интерстициальных коллагенов. Этот коллаген широко представлен в хрящевом матриксе, но больше всего его содержится в межпозвоночных дисках: в nucleus pulposus он составляет -20% общего коллагена. Две молекулы этого коллагена соединяются антипараллельно с образованием димера. Из димеров образуются тетрамеры, которые секретируются из клетки, и вне клетки

Рис. 15-9. Возможный механизм образования гексагональных решёток молекулами коллагена VIII типа. 1 - мономер; 2 - димер; 3 - тетрамер; 4 - гексагональные решётки.
связываются "конец в конец" с образованием микрофибрилл (рис. 15-10)
Функции коллагена VI типа пока полностью не ясны, хотя известно, что его микрофибриллы могут связываться со многими компонентами межклеточного матрикса: фибриллами интерстициальных коллагенов, гиалуроновой кислотой, протеогликанами. Молекула этого коллагена содержит многочисленные последовательности Арг-Гли-Асп (RGD), поэтому возможно его участие в клеточной адгезии через присоединение к мембранным адгезивным молекулам, например интегринам α1β1 и α2β1.
Коллагены, образующие "заякоренные" фибриллы
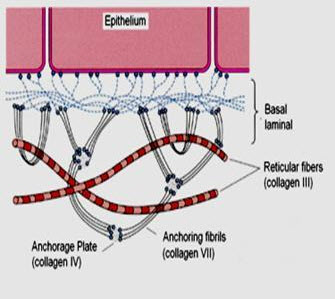
К этому классу относят коллагены VII и XVII типов, которые называют также коллагенами, связанными с эпителием, так как они обычно находятся в местах соединения эпителия с субэпителиальными слоями.
Коллаген VII типа - основной структурный компонент "заякоренных" фибрилл. Каждая молекула этого белка содержит два неколлагеновых домена (НК1 - у С-конца, НК2 - у N-конца) и один коллагеновый домен между ними. Из мономеров образуются димеры, при этом молекулы соединяются в области НК2-доменов антипараллельно по отношению друг к другу. Затем НК2домены отщепляются, и димеры соединяются между собой "бок о бок" с образованием фибрилл (рис. 15-11).
Эти фибриллы играют важную роль в присоединении эпидермиса к дерме, так как одним концом они могут присоединяться к lamina densa, на которой лежит кожный эпителий, а другой их конец проникает в более глубокие субэпидермальные слои кожи и связывается там со структурами, называемыми "якорные диски".
Коллаген XVII типа представляет собой трансмембранный белок и обычно находится в гемидесмосомах эпидермиса. Предполагают, что этот коллаген взаимодействует с другими молекулами гемидесмосом и таким образом участвует в процессе присоединения эпидермиса к дерме.

синтез и созревание коллагена
Коллаген
 Коллаген - это фибриллярный белок, составляющий основу соединительной ткани организма и обеспечивающий ее прочность и эластичность. (Соединительная ткань находится в костях, стенках сосудов, сухожилиях, связках, и конечно, в нашей коже.) Коллаген обнаружен у многоклеточных животных, но отсутствует у растений, бактерий, вирусов, простейших и грибов. Это основной компонент соединительной ткани и самый распространенный протеин у млекопитающих, составляющий от 25% до 35% протеинов во всём теле.
Коллаген - это фибриллярный белок, составляющий основу соединительной ткани организма и обеспечивающий ее прочность и эластичность. (Соединительная ткань находится в костях, стенках сосудов, сухожилиях, связках, и конечно, в нашей коже.) Коллаген обнаружен у многоклеточных животных, но отсутствует у растений, бактерий, вирусов, простейших и грибов. Это основной компонент соединительной ткани и самый распространенный протеин у млекопитающих, составляющий от 25% до 35% протеинов во всём теле.
Многие ученые десятилетиями не могли понять молекулярное строение коллагена. Первое доказательство того, что коллаген имеет постоянную структуру на молекулярном уровне, было представлено в середине 30-х годов прошлого века. С того времени много выдающихся ученых, включая Нобелевских лауреатов, таких как, Фрэнсис Крик, Лайнус Полинг, Александр Рич, Ада Йонат, Хелен Берман, Вилеайнур Рамачандран работали над строением мономера коллагена. В итоге результатом этих работ стало создание троично-спиральной модели, объяснившей четвертичную структуру молекулы коллагена.
Молекула коллагена представляет собой правозакрученную спираль из трёх α-цепей тропоколлагна, т.е. Три полипептидные цепи (около 1000 аминокислот каждая), скручиваясь, образуют молекулу тропоколлагена размерами 300 нм. х 1,5 нм.
Эта спиралевидная структура, напоминающая три переплетенные пружины, способные скручиваться и возвращаться в исходное состояние и придает молодой коже упругость, гладкость и эластичность.
В фибриллярных коллагенах молекулы смещены относительно друг друга примерно на 67 нм. (D-период).
Соотношение (300:67) не дает целого числа, и поэтому длина молекулы коллагена разделена на непостоянные по величине отрезки.
Соответственно, непостоянство этих отрезков во многом определяет свойства коллагена в образующихся путем агрегации микрофибрилл.
Коллагеновая фибрилла — это полукристаллическая структурная единица коллагена, а коллагеновые волокна образуются путем агрегации микрофибрилл.

Синтез коллагена — сложный ферментативный многостадийный процесс, который должен быть обеспечен достаточным количеством витаминов и минеральных элементов!
Синтез протекает в фибробласте и ряд стадий вне фибробласта. Важный момент в синтезе — реакции гидроксилирования, которые открывают путь дальнейшим модификациям, необходимым для созревания коллагена.
Катализируют реакции гидроксилирования специфические ферменты.
Так, образование 4-оксипролина катализирует пролингидроксилаза, в активном центре которой находится железо.
Фермент активен в том случае, если железо находится в двухвалентной форме, что обеспечивается аскорбиновой кислотой (витамин C).
Дефицит аскорбиновой кислоты нарушает процесс гидроксилирования, что влияет на дальнейшие стадии синтеза коллагена- гликозилирование, отщепление N- и С-концевых пептидов и др.
В результате синтезируется аномальный коллаген, более рыхлый.
Эти изменения лежат в основе развития цинги.
Коллаген существует в нескольких формах, при этом основная структура всех типов коллагена является схожей. В настоящее время описано 28 типов коллагена, которые кодируются более чем 40 генами. Они отличаются друг от друга по аминокислотной последовательности, а также по степени модификации — интенсивности гидроксилирования или гликозилирования. Общим для всех коллагенов является существование 1 или более доменов, содержащих тройную спираль и присутствие их во внеклеточном матриксе. Более 90 % всего коллагена высших организмов приходится на коллагены I, II,III и IV типов.
| Разновидности коллагена | Типы |
| Фибриллярные коллагены | I, II, III, V, XI, XXIV, XXVII |
| Фибрилл-ассоциированные коллагены (FACIT) | X, XII, XIV, XVI, XIX, XX, XXI, XXII |
| Коллагены, формирующие филаменты- бусины (beaded filament forming) | VI |
| Сетеобразующие коллагены | IV, VIII, X |
| Коллаген, формирующий якорные фибриллы | VII |
| Трансмембранные коллагены | XIII, XVII, XXIII, XXV/CLAC-P |
| Другие коллагены | XXVIII, XV, XVIII |
Коллаген I типа поддерживает структуру и функции кожи.
Дерма, которая формирует структурный каркас для сосудов и придатков кожи, а также эпидермиса, состоит преимущественно из межклеточного вещества. Структурными компонентами этого межклеточного вещества (матрикса) являются белки нескольких типов, протеогликаны и глюкозаминогликаны, продуцируемые и секретируемые фибробластами.
Основной белковый компонент кожи человека - коллаген I типа, который составляет 90% от массы ее сухого вещества.
Уникальные физические свойства волокон коллагена обеспечивают структурную целостность кожи. Фибриллы коллагена I, III, IV и V типов самоорганизуются в более крупные волокна коллагена, которые формируют в дерме трехмерную структурную сеть.