Б. Особенности структуры и функции разных типов коллагенов
19 типов коллагена подразделяют на несколько классов в зависимости от того, какие структуры они могут образовывать. Эти структуры представлены в табл. 15-2.
Фибриллообразующие (I, II, III, V и XI) типы
95% всего коллагена в организме человека составляют коллагены I, II и III типов, которые образуют очень прочные фибриллы. Значительное содержание именно этих типов коллагена объясняется тем, что они являются основными структурными компонентами органов и тканей, которые испытывают постоянную или периодическую
Таблица 15-2. Классификация коллагенов по видам структур, которые они образуют
| Структура | Тип |
| Фибриллы | I, II, III, V, XI |
| Ассоциированные с | IX, XII, XIV, XVI, |
| Фибриллами | XIX |
| Сети | IV, VIII, X |
| Микрофибриллы | VI |
| «Заякоренные» фибриллы | VII |
| Трансмембранные домены | XIII, XVII |
| Другие | XV, XVIII |
механическую нагрузку (кости, сухожилия, хрящи, межпозвоночные диски, кровеносные сосуды), а также участвуют в образовании стромы паренхиматозных органов. Поэтому коллагены I, II и III типов часто называют интерстициальными. К классу фибриллообразующих относят также минорные коллагены V и XI типов.
Структура фибрилл коллагена и их формирование
Основа структурной организации коллагеновых фибрилл - ступенчато расположенные параллельные ряды молекул тропоколлагена, которые сдвинуты на 1/4 относительно друг друга (рис. 15-3).
На схеме хорошо видно, что молекулы коллагена не связаны между собой "конец в конец", а между ними имеется промежуток в 35 - 40 нм. Предполагается, что в костной ткани эти промежутки выполняют роль центров минерализации, где откладываются кристаллы фосфата кальция. При электронной микроскопии фиксированные и контрастированные фибриллы коллагена выглядят поперечно исчерченными с периодом 67 нм, который включает одну тёмную и одну светлую полоски. Считают, что такое строение максимально повышает сопротивление всего агрегата растягивающим нагрузкам.
Фибриллы коллагена образуются спонтанно, путём самосборки. Но эти фибриллы ещё не являются зрелыми, так как не обладают достаточной прочностью (известно, что зрелое коллагеновое волокно толщиной в 1 мм выдерживает нагрузку до 10 кг).
Образовавшиеся коллагеновые фибриллы укрепляются внутри- и межцепочечными ковалентными сшивками (они встречаются только в коллагене и эластине). Эти сшивки образуются следующим образом:
- внеклеточный медьсодержащий фермент ли-зилоксидаза осуществляет окислительное дезаминирование ε-аминогрупп в некоторых остатках лизина и гидроксилизина с образованием реактивных альдегидов (аллизина и гидроксиаллизина). Для этих реакций необходимо присутствие витаминов РР и В6 (рис. 15-4).
- образовавшиеся реактивные альдегиды участвуют в формировании ковалентных связей между собой, а также с другими остатками лизина или гидроксилизина соседних молекул тропоколлагена, и в результате возникают поперечные "Лиз-Лизсшивки", стабилизирующие фибриллы коллагена (рис. 15-5).
Количество поперечных связей в фибриллах коллагена зависит от функции и возраста ткани. Например, между молекулами коллагена
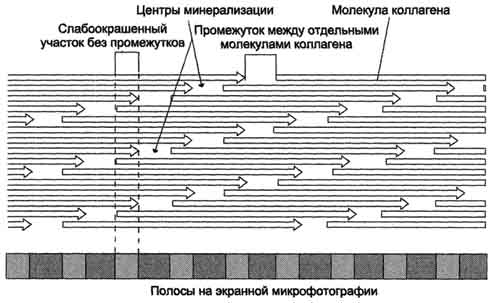
Рис. 15-3. Схема ступенчатого расположения молекул коллагена в коллагеновой фибрилле.

Рис. 15-4. Образование поперечных связей в коллагене. А - образование альдольной поперечной сшивки из двух боковых цепей лизина; Б - образование шиффовых оснований из боковых цепей лизина и аллизина.
ахиллова сухожилия сшивок особенно много, так как для этой структуры важна большая прочность. С возрастом количество поперечных связей в фибриллах коллагена возрастает, что приводит к замедлению скорости его обмена у пожилых и старых людей.
При снижении активности лизилоксидазы, а также при недостатке меди или витаминов РР или В6 нарушается образование поперечных сшивок и, как следствие, снижаются прочность и упругость коллагеновых волокон. Такие структуры, как кожа, сухожилия, кровеносные сосуды, становятся хрупкими, легко разрываются. Подробнее эти вопросы рассматриваются ниже в подразделе, посвящённом эластину.
Коллагены, ассоциированные с фибриллами
Этот класс объединяет коллагены, которые выполняют очень важную функцию: они ограничивают размер фибрилл, образуемых интерстициальными коллагенами (прежде всего, I и II типов), и участвуют в организации межклеточного матрикса в костях, коже, хрящах, сухожилиях. К этим коллагенам относят коллагены IX, XII, XIV и XVI типов. Коллагены этого класса сами фибрилл не формируют, но непосредственно
связаны с фибриллами, которые образуют интерстициальные коллагены. Функционирование таких типов коллагенов можно рассмотреть на примере коллагена IX типа, который в хряще связан с фибриллами коллагена II типа, он присоединяется к ним антипараллельно с периодичностью ~67 нм (рис. 15-6).
Коллаген IX типа состоит из трёх коллагеновых (фибриллярных) доменов (Кол1 → Кол3) и четырёх неколлагеновых (глобулярных) доменов (НК1 → НК4) (нумерация с С-конца) (рис. 15-7).
Коллаген IX типа связан с фибриллами коллагена II типа поперечными "Лиз-Лиз-мостиками" в области доменов Кол1 и Кол2, а также и НК1, НК2 и НК3.
НК4-домен не связан с фибриллами коллагена II типа; к его особенностям относят наличие большого количества положительно заряженных групп, поэтому к нему могут присоединяться отрицательно заряженные гликозаминогликаны, например, гиалуроновая кислота и хондроитинсульфат. Эти особенности обеспечивают участие коллагена IX типа в организации межклеточного матрикса в хряще.