Предельные углеводороды
Алканами называются предельные (насыщенные) углеводороды, содержащие только простые связи С-С. Общая формула алканов - СnН2n+2. Названия простейших алканов сложились исторически, для остальных - производятся от греческих числительных добавлением суффикса - ан.
| СН4 | метан | С5Н10 | пентан | С9Н20 | нонан |
| С2Н6 | этан | С6Н12 | гексан | С10Н22 | декан |
| С3Н8 | пропан | С7Н16 | гептан | С11Н24 | ундекан |
| С4Н10 | бутан | С8Н18 | октан | С12Н26 | додекан |
Алканы с числом атомов углерода больше четырех имеют скелетные изомеры. Разветвленные предельные углеводороды рассматривают как алканы, в которых некоторые атомы водорода заменены на радикалы. Структуры и названия простейших радикалов необходимо запомнить.
Физические свойства
Первые четыре алкана - газы, далее до алкана С16Н34 - жидкости, остальные - твердые вещества. Все они нерастворимы в воде.
Получение
I. Основной промышленный метод - переработка нефти и газа:
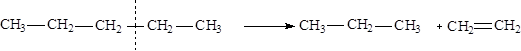 |
перегонка - физический процесс разделения нефти на фракции с различными температурами кипения углеводородов: бензин (40-150 °С), лигроин (120-240 °С), керосин (150-300 °С) и соляровое масло(>300 °С);
крекинг:
получение алканов из угля и водорода при высокой температуре:
С+2Н2 ¾® СН4.
нагреванием оксида углерода(П) с водородом в присутствии катализатора:
nСО + (2n+1) H2 ¾® CnH2n+2 + nН20
II. Лабораторные методы.
 |
Восстановление непредельных соединений:
Сплавление натриевых солей карбоновых кислот со щелочью:
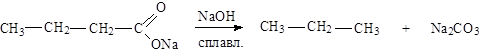 |
Взаимодействие галогенопроизводных с металлическим натрием (реакция Вюрца):
СНз¾Вг + 2 Na + Br-CH3 ¾® СНз¾СНз + 2 NaBr
Этот метод удобен для получения симметричных алканов, в противном случае образуется смесь продуктов.
Химические свойства алканов
Благодаря своей предельной насыщенности и малой полярности связей С-Н алканы очень прочны, вступают только в реакции радикального замещения, инициируемого условиями проведения реакции.
Галогенирование - протекает на свету. Обычно не заканчивается замещением одного атома водорода, приводя к смеси моно-, ди-, три- и т.д. галогенпроизводных.
CH3¾CH3 + Cl2 ¾® CH3¾CH2¾Cl + HCl (SR)
Каждая такая реакция протекает в соответствии с цепным свободно-радикальным механизмом:
 |
Инициирование цепи:
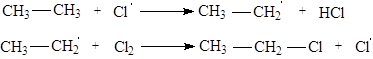 |
Рост цепи:
 |
Обрыв цепи:
2) Нитрование (реакция Коновалова).
Взаимодействие алканов с разбавленной азотной кислотой (12%) при повышенных температуре и давлении.
СНз¾СНз + HO¾NO2 ¾® CH3¾CH2¾NO2 + Н2O
3 ) Окисление.
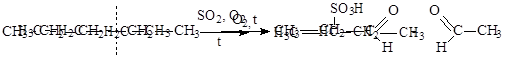 |
Мягкие окислители (бромная вода, перманганат калия) на алканы не действуют. Любые алканы сгорают до углекислого газа и воды с выделением большого количества тепла.
Сульфоокисление.
Крекинг – это и способ получения, и химическое свойство алканов и алкенов. Процесс проходит при высокой температуре, давлении и обычно в присутствии катализаторов.
Циклоалканы: общая формула класса CnH2n, т.е. циклоалканы изомерны алкенам. Названия образуются прибавлением приставки цикло- к названию соответвующего алкана.
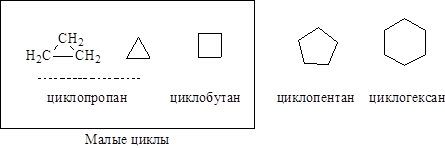 |
Циклопропан оказывает сильное наркотическое действие, применяется при хирургических операциях. Циклопентатвые и циклогексановые кольца содержатся в некоторых природных веществах.
Получение
 |
Действие металлического цинка на дигалогенпроизводные.
 |
Гидрирование ароматических углеводородов.
Химические свойства
Химические свойства циклоалканов аналогичны реакциям алканов, но для малых циклов (циклопропан, циклобутан) характерны реакции присоединения с разрывом цикла.
Непредельные углеводороды
 |
Алкены
Углеводороды, содержащие двойную связь С=С, называются алкенами или этиленовыми углеводородами. Общая формула класса – СnН2n.
Названия образуются заменой суффикса -ан в алканах на -ен. Для родоначальника ряда часто применяется тривиальное название "этилен".
Благодаря двойной связи, в алкенах помимо скелетной изомерии наблюдается пространственная цис-транс-изомерня.
Физические свойства
Алкены с числом атомов углерода менее пяти - газы. Нерастворимы в воде, но растворяются в неполярных растворителях.
Получение
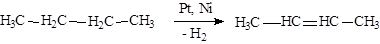 |
Дегидрирование алканов при повышенном давлении и температуре в присутствии катализатора (обычно Pt):
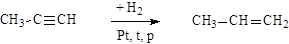 |
Неполное гидрирование алкинов:
Отщепление функциональной группы и водорода в соседнем положении. Отщепление происходит по правилу Зайцева:
При образовании алкена из функционального производного углеводородов отщепляется функциональная группа и водород от соседнего наименее гидрированного атома углерода.
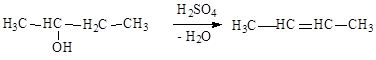 |
-внутримолекулярная дегидратация спиртов в присутствии серной кислоты или оксида алюминия:
 |
дегидрогалогенирование моногалогенопроизводных действием спиртового раствора щелочи:
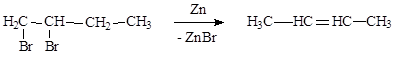 |
Действие металлического цинка на дигалогенопроизводные:
Химические свойства
Двойная связь в алкенах состоит из s- и p-связей. p-Связь, образованная боковым перекрыванием негибридных р-орбиталей, менее прочна и легко разрывается под действием многих реагентов. Поэтому для алкенов характерны реакции присоединения с разрывом p-связи AE. Так как p-связь является областью с повышенной электронной плотностью, реагентом в
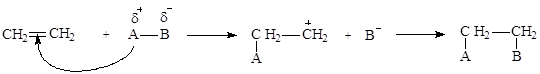 |
данных реакциях служит злектрофил (положительно заряженная частица):
Гидрирование в присутствии катализаторов - Pt, Pd, Ni (см. химические свойства алканов).
Галогенирование:
 |
Обесцвечивание бромной воды (при обычных условиях) является качественной реакцией на кратную связь.
3) Гидрогалогенирование. - происходит в соответствии с правилом Марковникова:
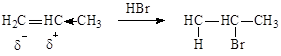 |
Присоединение полярных реагентов к несимметричной кратной связи происходит так, чтобы атом водорода присоединялся к наиболее гидрированному атому углерода.
4) Гидратация.
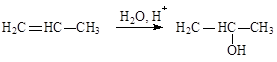 |
Протекает при нагревании в присутствии кислот (по правилу Марковникова).
 |
Полимеризация:
6) Окисление.
 |
Алкены обесцвечивают водный раствор перманганата калия, сами при этом окисляясь до двухатомных спиртов - гликолей.
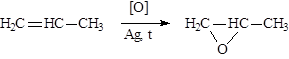 |
В присутствии металлического серебра образуются эпоксиды (a-окиси):
Диеновые углеводороды
Углеводороды, которые содержат две двойные связи, называют диенами (более двух - полценами). Общая формула гомологического ряда диенов CnH2n-2. В зависимости от расположения кратных связей выделяют сопряженные диены (двойные связи разделены одной простой), изолированные (между двойными связями более одной простой) и кумулированные (двойные связи по соседству).
sp2; s; p; p Cопряжение:
Способы получения
 |
Одновременная дегидратация и дегидрирование двух молекул этилового спирта (синтез Лебедева):
 |
Внутримолекулярной дегидратацией диолов:
Получение изопрена из пропилена:
Химические свойства сопряжённых диенов
 |
Наиболее характерные реакции - реакции присоединения. Для сопряженных диенов характерно либо 1,2-присоединение (с разрывом только одной связи), либо 1,4-присоединение, где две кратных связи реагируют как единая электронная система:
 |
Примером реакции присоединения к сопряжённым диенам является полимеризация:
Последним способом получают искусственные (синтетические) каучуки, основным отличием которых от природных долгое время было отсутствие стереорегулярности (повторяемости пространственной структуры мономерного звена). В настоящее время возможен синтез искусственных каучуков стереорегулярного строения.
Алкины
Алкины - углеводороды, содержащие в своем составе тройную связь. Общая формула - СnН2n-2. Молекулы алкинов имеют линейное строение благодаря sp-гибридиэации атомов углерода, связанных тройной связью.
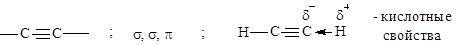 |
В международной номенклатуре им соответствует суффикс -ин. Первый представитель ряда традиционно именуется ацетиленом.
Физические свойства сходны со свойствами других углеводородов.
Получение
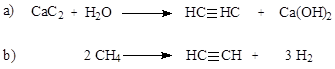 |
Получение ацетилена:
Синтез гомологов ацетилена.
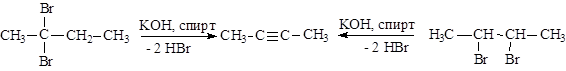 |
а) дегидрогалогенирование дигалогенпроизводных:
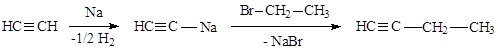 |
б) Алкилированием ацетиленидов галогеналкилами:
Химические свойства
 |
Гидрирование (проходит в два этапа):
Галогенирование (проходит в два этапа):
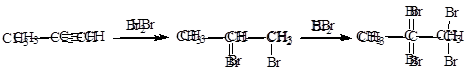 |
Гидрогалогенирование (проходит в два этапа):
Присоединение водородсодержащих реагентов к несимметричным алкинам происходит по правилу Марковникова.
Реакция гидратации (реакция Кучерова) протекает в присутствии солей
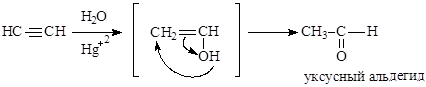 |
двухвалентной ртути и приводит к непредельному спирту, изомеризующемуся в карбонильное соединение.
Реакции замещения водорода у концевой тройной связи:
 |
Благодаря ослаблению связи между атомами углерода и водорода ацетилен и его гомологи с концевым положением тройной связи могут вступать в реакции замещения с активными металлами (см. способы получения алкинов) и с оксидами металлов, проявляя слабые кислотные свойства (реакция является качественной на концевую тройную связь).
4) Реакции полимеризации.
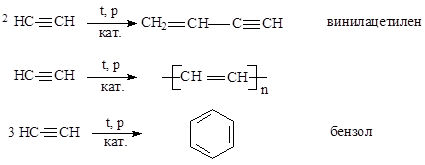 |
Димеризацией ацетилена получают винилацетилен (исходное вещество для синтеза некоторых диеновых полимеров), тримеризация приводит к бензолу, а полимеризация дает химически активные полимеры.
Окисление ацетилена водным раствором перманганата калия приводит к щавелевой кислоте. Обесцвечивание раствора КмnО4 является качественной реакцией на двойную и тройную связи.
Арены
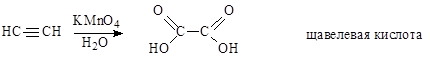 |
Арены - углеводороды, в состав которых входят циклы из шести атомов углерода, содержащие по три сопряженные двойные связи. Простейшим ареном является бензол С6Н6. Все атомы углерода в этом соединении находятся в состоянии sp2-гибpидизaции, а молекула имеет плоскую структуру с углами 1200, что приводит к выравниванию связей по всему кольцу и образованию единого облака p-электронов над и под плоскостью молекулы (отображается кольцом в формуле молекул). Соединения с такой структурой называют ароматическими.
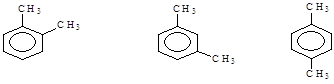 |
Для дизамещенных гомологов возможна изомерия расположения групп. Различное взаимное расположение групп носит название орто-, мета- и пара:
орто -ксилол мета -ксилол пара -ксилол
1,2-диметилбензол 1,3-диметилбензол 1,3-диметилбензол
Бензол и его гомологи, содержащие до 10 атомов углерода - жидкости, далее - твердые вещества.
Получение
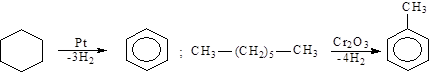 |
Из природных источников – нефть, каменный уголь.
Дегидрирование циклоалканов и алканов:
 |
Тримеризация алкинов (см. «Химические свойства алкинов»).
Гомологи бензола получают алкилированием бензола:
Химические свойства
I. Реакции электрофильного замещения.
Ароматическая система связей в бензоле приводит к особому типу реакций - реакциям замещения в бензольном кольце. При этом двойные связи не разрываются, а происходит замещение атомов водорода с сохранением ароматического цикла.
Галогенирование:
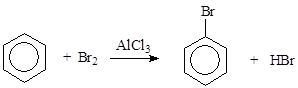 |
Проводится в присутствии катализатора А1С13, А1Вг3 или FeВг3.
Реакция протекает по следующему механизму:
Образование электрофильной частицы Вг+.
Координация электрофильной частицы к электронной плотности бензольного кольца (образование p-комплекса).
Присоединение частицы (образование s-комплекса).
Стабилизация неустойчивого s-комплекса с выбросом протона.
 |
Регенерация катализатора.
Нитрование:
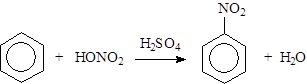 |
Протекает под действием смеси концентрированных азотной и серной кислот (нитрующая смесь).
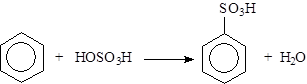 |
Сульфирование под действием концентрированной серной кислоты:
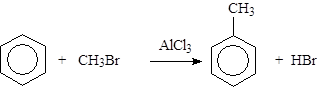 |
Алкилирование:
 |
Те же реакции замещения идут и для гомологов бензола, причем образуется смесь продуктов орто- и пара-замещения. Например, нитрование толуола приводит к орто- и пара-нитротолуолу:
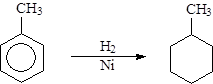 |
Ill Реакции присоединения (немногочисленны).
Гидрирование ( в присутствии катализатора ).
2) Присоединение галогенов.
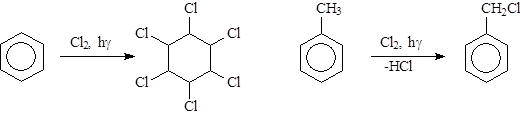 |
При интенсивном освещении бензол может присоединять три молекулы хлора, превращаясь в гексахлорциклогексан. Гомологи бензола на свету хлорируются иначе, замещая атом водорода в алкильном радикале в бензильном положении.
III. Реакции окисления.
 |
Бензол устойчив к действию мягких окислителей, а его гомологи окисляются до бензойной кислоты.