Строение дыхательной цепи митохондрий На внутренней мембране этих органоидов локализовано 8 оксидоредуктаз, коферменты которых располагаются последовательно в следующем порядке:
Ц и т о х р о м ы
S-H2 2е- НАД 2е- ФМН 2е- убихинон 2е- Ц. b
2Н+ 2Н+ 2 Н + 2Н+
Н 2О
-------------------- АТФ ----------------- АТФ
2е- Ц. c1 2е- Ц. c 2е- Ц. a 2е- Ц. a3 2е-
½ О2
АТФ
Первый кофермент – НАД. Он принимает ионы водорода и электроны от субстрата S-H2, находящегося за пределами дыхательной цепи. Акцептором их является атом углерода никотинамида, находящийся в 4-м положении. Образовавшийся НАД-Н2 передает ионы водорода и электроны ФМН, где они присоединяются к атомам азота изоалаксозинового цикла. От ФМН-Н2 ионы водорода и электроны переходят на убихинон. Первые из них временно остаются на убихиноне и в дальнейшем, соединяясь с атомом активированного кислорода, образуют молекулу воды. От убихинона електроны передаются на цитохром b, присоединяясь к атому железа гема, который меняет свою валентность с 3 на 2.. От цитохром b они перемещаются последовательно на цитохромы с1, с, а и а3. При каждом таком переходе электрона от одного фермента дыхательной цепи митохондрий к другом происходит постепенная потеря энергии и на цитохром а3 (цитохромоксидазу) переходит лишь остаток ее. Последний передается на молекулу кислорода, поступившую в клетку через кровь из легких, активируя ее. Активированный кислород после этого соединяется с ионами водорода, отщепившимися от убихинона и образуется вода, конечный продукт биологического окисления. Генерации АТФ ферментами дыхательной цепи митохондрий. Каждые два фермента дыхательной цепи митохондрий образуют редокс-пару. Между ними имеются определенный окислительно-восстановительный отенциал (ОВП), э.д.с., выражающаяся в вольтах. В процессе переноса электронов происходит постепенное увеличение ОВП. У НАД он равен -0,32 в, у кислорода - +0,81 в. Генерация АТФ в дыхательной цепи митохондрий происходит на тех участках ее, где различие в ОВП между компонентами редокс-пары составляет не менее 0,2 в. Таких участков 3: 1) между НАД и ФМН; 2) между цитохромами b и c1; 3) между цитохромами а и а3.Поэтому при окислении ферментами дыхательной цепи митохондрий одной молекулы НАД-Н2 генерируется 3 молекулы АТФ. Если же окисляется ФАД-Н2, то ионы водорода и электроны передаются от него на ФМН, минуя первый пункт генерации АТФ, между НАД и ФМН. Поэтому произойдет генерация только двух молекул АТФ. Согласно теории П. Митчелла, энергия, отдаваемая электронами при прохождении через эти участки дыхательной цепи, используется для перемещения положительно заряженных ионов водорода из внутреннего пространства митохондрий (матрикса) в пространство между внутренней и наружной мембранами их, т.е. на наружную поверхность внутренней мембраны этих органоидов (ВММ). Вследствие этого на последней накапливается избыток ионов водорода. При этом на внутренней поверхности ВММ содержится избыток отрицательно заряженных электронов. Поэтому создается разница потенциалов между наружной и внутренней поверхностями ВММ (мембранный потенциал). Из-за наличия этого потенциала ионы водорода стремятся вернуться обратно в матрикс. Для этого они использую специальный канал, расположенный внутри фермента протонная АТФ-аза, расположенная на ВММ. Во время прохождения через этот канал ионов водорода выделяется энергия, которая используется для генерации из АДФ и фосфорной кислоты АТФ (окислительного фосфорилирования). Следовательно протонная АТФ-аза функционирует как АТФ- синтетаза.
44.Реакция цикла кребса. Биологическая роль цикла Кребса. 1. При расщеплении одной молекулы ацетил-КоА в цикле Кребса высвобождается 2 молекулы углекислого газа – в результате изоцитатде-гидрогеназной и ά-кетоглутаратде-гидрогеназной реаций. Первая из них сопряжена с прямым декарбокси-лированием, вторая – окислительным. Углекислый газ в основном выделяется легкими, но он может участвовать в функционировании буферных систем крови. 2. В цикле Кребса восстанавливается 3 молекулы НАД и 1 молекула ФАД. Они переносят ионы водорода в дыхательную цепь митохондрий, где из них может генерироваться 11 молекул АТФ. НАД-Н2 генерируется в изоцитатдегидрогеназной, изоцитатдегидрогеназной и ά-кетоглутаратдегидрогеназной реаций атдегидрогеназной и малатдегидрогеназной реациях, ФАД-Н2 – в сукцинатдегидрогеназной реакции. Непосредственно цикле Кребса в результате реакции субстратного фосфорилирования, сукциниотиокиназной реакции, также может генерироваться одна молекула гуанозинтрифосфата (ГТФ), способная передавать энергию для синтеза АТФ. 3. Генерируемые в цикле Кребса ά-кетоглутаровая и щавелевоуксусная кислоты участвуют в реакциях переаминирования аминокислот. 4. В цикле Кребса окисляется сукцинил-КоА, образующийся в преджелудках жвачных животных в процессе расщепления микрофлорой клетчатки.
45. Генерация НАД-Н, ФАД-Н и АТФ в реакциях цикла Кребса. В цикле Кребса восстанавливается 3 молекулы НАД и 1 молекула ФАД. Они переносят ионы водорода в дыхательную цепь митохондрий, где из них может генерироваться 11 молекул АТФ. НАД-Н2 генерируется в изоцитат-дегидрогеназной, изоцитатдегидрогеназной и ά-кетоглутаратдегидрогеназной реаций атдегидрогеназной и малатдегидрогеназной реациях, ФАД-Н2 – в сукцинатдегид-рогеназной реакции. Непосредственно цикле Кребса в результате реакции субстратного фосфорилирования, сукцини-отиокиназной реакции, также может генерироваться одна молекула гуанозинтри-фосфата (ГТФ), способная передавать энергию для синтеза АТФ.
За один оборот цикла, состоящего из восьми ферментативных реакций, происходит полное окисление («сгорание») одной молекулы ацетил-КоА. Для непрерывной работы цикла необходимо постоянное поступление в систему ацетил-КоА, а коферменты (НАД+ и ФАД), перешедшие в восстановленное состояние, должны снова и снова окисляться. Это окисление осуществляется в системе переносчиков электронов в дыхательной цепи (в цепи дыхательных ферментов), локализованной в мембране митохондрий. Образовавшийся ФАДН2 прочно связан с СДГ, поэтому он передает атомы водорода через KoQ. Освобождающаяся в результате окисления ацетил-КоА энергия в значительной мере сосредоточивается в макроэргических фосфатных связях АТФ. Из 4 пар атомовводорода 3 пары переносят НАДН на систему транспорта электронов; при этом в расчете на каждую пару в системе биологического окисления образуется 3 молекулы АТФ (в процессе сопряженного окислительного фосфорилирования), а всего, следовательно, 9 молекул. Одна пара атомов от сукцинатдегидрогеназы-ФАДН2 попадает в систему транспорта электронов через KoQ, в результате образуется только 2 молекулы АТФ. В ходе цикла Кребса синтезируется также одна молекула ГТФ (субстратное фосфорилирование), что равносильно одной молекуле АТФ. Итак, при окислении одной молекулы ацетил-КоА в цикле Кребса и системе окислительного фосфорилирования может образоваться 12 молекул АТФ.
46. Гидролиз углеводов в органах пищеварительной системы. В полости рта пищевой комок измельчается. В нем крахмал расщепляются амилазой слюны до их фрагментов – амилодекстринов, дающих с иодом фиолетовое окрашивание. У свиней и у жвачных животных амилаза в много раз активнее, чем у человека.В слюне содержится также мальтаза, расщепляющая мальтозу.Пищевой комок поступает в желудок, где постепенно пропитывается хлористоводородной кислотой. За это время внутри его амидекстрины успевают расщепиться до эритродекстринов, образующих с иодом красное окрашивание. В преджелудках жвачных животных находящиеся там микроорганизмы расщепляют клетчатку до пропионовой кислоты. Последняя активируется в пропионил-КоА, который в результате двух последовательных реакций превращается в активную форму янтарной кислоты (сукцинил-КоА)
О
//
СН3-СН2-С-S-КоА+АТФ+СО2 Пропионилкарбоксилаза
Пропионил-КоА Кофермент-биотин
СООН
/
СН3-СН-СО-S-КоА +АДФ+Ф
Метилмалонил-КоА
СООН
│
СН3-СН-СО-S-КоА Метилмалонилмутаза
Метилмалонил-КоА Кофермент–кобаламин
О
//
НООС-СН2-СН2-С-S-КоА
Сукцинил-КоА
Кофермент метилмалонилмутазы, кобаламин (витамин В12), вырабатывается микроорганизмами преджелудков. Сукцинил-Коа в дальнейшем окисляется в цикле Кребса. В 12-персной кишке кислое желудочной содержимое нейтрализуется карбонатами кишечного сока до слабощелочной среды. Поступившие из желудка дестрины продолжают расщепляться ά-амилазой до ахродекстринов, не дающих с иодом окрашивания. Они расщепляются олиго-1,6-гликозидазой до еще более мелких декстринов, в которых 1-6 связи (места ветвления радикалов ά-D-глюкопиранозы) гидролизуются амило-1,6-гликозидазой. Образующиеся молекулы мальтозы расщепляются мальтазой на 2 молекулы глюкозы. Аналогичным превращениям подвергается гликоген, но продукты его расщепления дают с иодом другую окраску. Расщепление мальтозы до двух молекул глюкозы начинается в ротовой полости и заканчивается в тонком кишечнике под действием мальтазы. В последнем сахароза под действием сахаразы расщепляется до глюкозы и фруктозы, а лактоза – под действием лактазы – до глюкозы и галактозы.
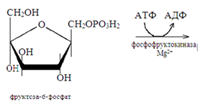
47. Механизм поддержания постоянтсва концентрации глюкозы в крови. Депонирование и расщепление гликогена в печенипроисходит с целью поддержания постоянства концентрации глюкозы в крови. У здоровых животных она равна 3,8-5,2 ммоль/л и сохраняется постоянной в течение суток. После приема пищи, когда повышается концентрация глюкозы в крови, по одному остатку ее постепенно откладывается в гликоген печени в результате следующих реакций:


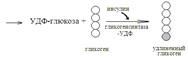
Этот процесс усиливает гормон поджелудочной железы инсулин, активирующий гликогенсинтазу. В промежутках между приемом пищи гликоген печени расщепляется в результате следующих реакций:
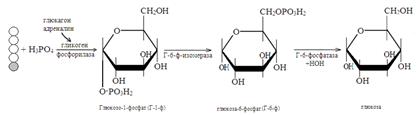
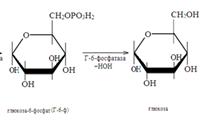
Этот процесс усиливает гормон поджелудочной железы глюкагон, активирующий гликогенфосфорилазу. При снижении концентрации глюкозы в крови от гликогена постепенно отщепляется по одному остатку ее, который поступает в кровь. При стрессовых ситуациях мозговым слоем надпочечников выделяется гормон адреналин, также активирующий гликогенфосфорилазу. Происходит усиленное поступление глюкозы в кровь.
48. Синтез гликогена в печени. Депонирование и расщепление гликогена в печенипроисходит с целью поддержания постоянства концентрации глюкозы в крови. У здоровых животных она равна 3,8-5,2 ммоль/л и сохраняется постоянной в течение суток. После приема пищи, когда повышается концентрация глюкозы в крови, по одному остатку ее постепенно откладывается в гликоген печени в результате следующих реакций:



Этот процесс усиливает гормон поджелудочной железы инсулин, активирующий гликогенсинтазу.
49. Ращепление гликогена в печени. В промежутках между приемом пищи гликоген печени расщепляется в результате следующих реакций:

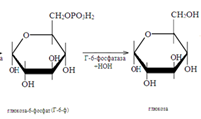
Этот процесс усиливает гормон поджелудочной железы глюкагон, активирующий гликогенфосфорилазу. При снижении концентрации глюкозы в крови от гликогена постепенно отщепляется по одному остатку ее, который поступает в кровь. При стрессовых ситуациях мозговым слоем надпочечников выделяется гормон адреналин, также активирующий гликогенфосфорилазу. Происходит усиленное поступление глюкозы в кровь.
50. Реакции анаэробного гликолиза. Окисление глюкозы в тканях. Этот процесс может протекать в отсутствии кислорода (анаэробный гликолиз), когда глюкоза расщепляется до молочной кислоты. В присутствии кислорода (аэробный гликолиз) она окисляется до углекислого газа и воды. Оба процесса, реакции которых совпадают до стадии образования пировиноградной кислоты, необходимы главным образом для генерации АТФ. Анаэробный гликолиз – источник АТФ у анаэробных микроорганизмов. У аэробных организмов функционирует наряду с аэробным гликолизом, дополняя его.

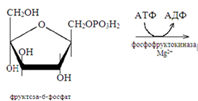

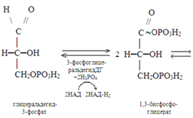
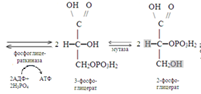
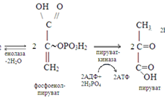
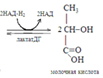
Анаэробное окисление гликогена в мышцах.При усиленном сокращении мышц в миоциты не успевает поступать кислород. В этих условия гликоген, содержащийся в мышцах, расщепляется гликогенфосфорилазой до глюкозо-1-фосфата. Последний превращается в результате фосфоглюкомутазной реакции в глюкозо-6-фосфат, который включается в реакции анаэробного гликолиза. При этом при окислении одного остатка глюкозы генерируется в конечном итоге 3 молекулы АТФ (при образовании глюкозо-1-фосфата АТФ не затрачивается). Физиологическая роль анаэробного гликолиза. Этот процесс является источником АТФ в клетках, особенно при недостатке кислорода в тканях. При окислении одной молекулы глюкозы в реакциях субстратного фосфорилирования образуется 4 молекулы АТФ: по 2 молекулы его в фосфоглицераткиназной и пируваткиназной реакциях. 2 молекулы АТФ затрачиваются на начальных этапах гликолиза: в гексокиназной фосфофруктокиназной реакциях. В конечном итоге, в реакциях анаэробного гликолиза из одной молекулы глюкозы генерируется 2 молекулы АТФ. При этом образуются 2 молекулы молочной кислоты, способные закислять ткани. Поэтому молочная кислота в реакциях глюкоконеогенеза обратно превращается в глюкозу.
50а. Биологическая роль анаэробного гликолиза. Анаэробное окисление гликогена в мышцах. При усиленном сокращении мышц в миоциты не успевает поступать кислород. В этих условия гликоген, содержащийся в мышцах, расщепляется гликогенфосфорилазой до глюкозо-1-фосфата. Последний превраща-ется в результате фосфоглюкомутазной реакции в глюкозо-6-фосфат, который включается в реакции анаэробного гликолиза. При этом при окислении одного остатка глюкозы генерируется в конечном итоге 3 молекулы АТФ (при образовании глюкозо-1-фосфата АТФ не затрачивается). Физиологическая роль анаэробного гликолиза. Этот процесс является источником АТФ в клетках, особенно при недостатке кислорода в тканях. При окислении одной молекулы глюкозы в реакциях субстратного фосфорилирования образуется 4 молекулы АТФ: по 2 молекулы его в фосфоглицераткиназной и пируваткиназной реакциях. 2 молекулы АТФ затрачиваются на начальных этапах гликолиза: в гексокиназной фосфофрук-токиназной реакциях. В конечном итоге, в реакциях анаэробного гликолиза из одной молекулы глюкозы генерируется 2 молекулы АТФ. При этом образуются 2 молекулы молочной кислоты, способные закислять ткани. Поэтому молочная кислота в реакциях глюкоконеогенеза обратно превращается в глюкозу.
51. Реакции анаэробного гликолиза, связанные с затратой и генерацией молекул АТФ. Окисление глюкозы в тканях. Этот процесс может протекать в отсутствии кислорода (анаэробный гликолиз), когда глюкоза расщепляется до молочной кислоты. В присутствии кислорода (аэробный гликолиз) она окисляется до углекислого газа и воды. Оба процесса, реакции которых совпадают до стадии образования пировиноградной кислоты, необходимы главным образом для генерации АТФ. Анаэробный гликолиз – источник АТФ у анаэробных микроорганизмов. У аэробных организмов функционирует наряду с аэробным гликолизом, дополняя его.





Анаэробное окисление гликогена в мышцах.При усиленном сокращении мышц в миоциты не успевает поступать кислород. В этих условия гликоген, содержащийся в мышцах, расщепляется гликогенфосфорилазой до глюкозо-1-фосфата. Последний превращается в результате фосфоглюкомутазной реакции в глюкозо-6-фосфат, который включается в реакции анаэробного гликолиза. При этом при окислении одного остатка глюкозы генерируется в конечном итоге 3 молекулы АТФ (при образовании глюкозо-1-фосфата АТФ не затрачивается). Физиологическая роль анаэробного гликолиза. Этот процесс является источником АТФ в клетках, особенно при недостатке кислорода в тканях. При окислении одной молекулы глюкозы в реакциях субстратного фосфорилирования образуется 4 молекулы АТФ: по 2 молекулы его в фосфоглицераткиназной и пируваткиназной реакциях. 2 молекулы АТФ затрачиваются на начальных этапах гликолиза: в гексокиназной фосфофруктокиназной реакциях. В конечном итоге, в реакциях анаэробного гликолиза из одной молекулы глюкозы генерируется 2 молекулы АТФ. При этом образуются 2 молекулы молочной кислоты, способные закислять ткани. Поэтому молочная кислота в реакциях глюкоконеогенеза обратно превращается в глюкозу.
52. Глюконеогенез: реакции, регуляция, биологическая роль. Глюконеогенез – образование глюкозы из неуглеводных источников: некоторых аминокислот, глицерола, молочной и пировиноградной кислот. Протекает в печени и в меньшей степени – в почках и слизистой оболочке кишечника. Является в основном процессом, обратным процессу гликолиза, реакции которого катализируют в обратном направлении те же ферменты, что и ферменты гликолиза, за исключение трех ферментов. Пируваткиназная, фосфофрук-токиназная и гексоконазная реакции протекают только а одном направлении. Реакцию, обратную пируваткиназной, катализируют 2 фермента: пируваткарбок-силаза и фосфоенолпируваткарбоксикиназа. Гидролиз фруктозо-1,6-бисфосфата до фруктозо-6-фосфата катализирует фрукто-зо-6-фосфатаза, а расщепление глюкозо-6-фосфата до глюкозы - глюкозо-6-фосфа-таза. Биосинтез четырех специфических ферментов глюконеогенеза усиливают гормоны коркового слоя надпочечников – глюкокортикоиды. 1. Обратными пируват-киназной являются реакции, катализируемые пируваткарбоксилазой (ПК-ой) и фосфоенолпируваткарбок-сикиназой (ФЕПКК-ой):

Обратной фосфофрукиокиназной являются реакция, катализируемая
фруктозо-1,6- бисфосфатазой (Ф-1,6-БФ-ой): 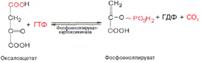
2. Обратная гексокиназной является реакция, катализируемая глюкозо-6- Фосфатазой (Г-6-Ф-ой):

Биологическая роль глюконеогенеза. Глюконеогенез из молочной кислоты усиливается при повышении в тканях ее уровня, вызванном физическими нагрузками или недостатком в организме кислорода. При этом молочная кислота вначале превращается в пировиноградную в результате реакции, катализируемой лактатдегидрогеназой. Глюконеогенез из аминокислот усиливается при хронических стрессовых ситуациях, сахарном диабете и других состояниях, приводящих к недостатку в организме углеводов. При этом некоторые аминокислоты предварительно превращаются в пировиноградную кислоту. Это приводит к усиленному образованию аммиака, обезвреживающегося в мочевину в реакциях орнитинового цикла.
53. Аэробный гликолиз и его биологическая роль. Аэробный гликолиз – основной источник АТФ в клетках.



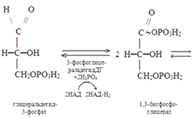
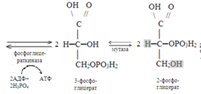
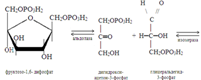
До стадии образования 3-фосфоглицераль-дегида реакции его совпадают с реакциями анаэробного гликолиза. В дальнейшем, в процессе превращения двух молекул 3-фосфоглицеральдегида в две молекулы 1,3-бисфосфоглицериновой кислоты из двух молекул НАД генерируются две молекулы НАД-Н2. При окислении последних в дыхательной цепи митохондрий выраба-тывается 6 молекул АТФ (2Х3). Реакции окисления двух молекул1,3-бисфосфоглиц-ериновой кислоты до двух молекул пировиноградной кислоты также совпадают с соответствующими реакциями анаэроб-ного гликолиза. В дальнейшем все идет по-другому: 2 молекулы пировиноградной кислоты превращаются в 2 молекулы ацетил-КоА:

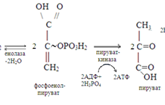
При этом происходит восстановление двух молекул НАД. При окислении двух молекул НАД-Н2 в дыхательной цепи митохондрий вырабатывается 6 молекул АТФ. Реакцию катализирует пируватдегидрогеназный комплекс, отщепляющий от молекул пирувата углекислый газ (окислительное декарбоксилирование) и присоединяющий к месту отщепления –S-КоА. В состав его входят 5 коферментов: НАД, ФАД, ТиаминДФ, HS-КоА и липоевая кислота. Образующиеся 2 молекула ацетил-КоА в дальнейшем окисляются в цикле Кребса. При этом генерируются 2 молекулы ГТФ, восстанавливаются 6 (2Х3)молекул НАД и 2 молекулы ФАД. При дальнейшем окислении НАД-Н2 и ФАД-Н2 в дыхательной цепи митохондрий генерируются 22 молекулы АТФ. Физиологическая роль аэробного гликолиза. 1.Этот процесс является основным источником АТФ в клетках. При окислении одной молекулы глюкозы затрачивается 2 молекулы АТФ (в гексокиназной и фосфофруктокиназной реакциях), но генерируется 40 его молекул в реакциях 3-фосфоглицеральдегиддегид-рогеназной – 6 АТФ, фосфоглицерат-киназной– 2 АТФ, пируваткиназной – 2 АТФ, пируватдегидрогеназной – 6 АТФ, изоцитратдегидрогеназной – 6 АТФ, α-кетоглутаратдегидрогеназной – 6 АТФ,
сукцинилтиокиназной – 2 АТФ, малатдегидрогеназной– 6 АТФ. Итого - 40 молекул АТФ. С учетом двух затраченных молекул АТФ энергетический эффект окисления одной молекулы глюкозы в реакция аэробного окисления глюкозы составляет 38 молекул АТФ. Конечными продуктами этого процесса являются углекислый газ и вода. 2. В реакциях аэробного гликолиза образуются метаболиты, необходимые для биосинтеза других веществ. Пировиноградная, щавелевоуксусная и α-кетоглутаровая кислоты участвуют в реакциях переаминирования аминокислот. 3-фосфоглицеральдегид используется для биосинтеза глицерола, а ацетил-КоА – жирных кислот, холестерола и т.д. Из пировиноградной кислоты синтезируется щавелевоуксусная кислота, необходимая для функционирования цикла Кребса.
54. Реакции окислительной ветви пентозного цикла. Аэробный гликолиз называют дихотомическим путем окисления углеводов, поскольку он протекает в 2 стадии: окисления глюкозы до пирувата и последнего – до углекислого газа и воды. Существует еще апотомический (прямой) путь окисления глюкозы – пентозный цикл или гексозомонофосфатный шунт. В нем окисляется около 2% глюкозы (в печени – 25%). Этот процесс условно делят на 2 части: реакции окислительной и пластической ветвей пентозного цикла. Первая реакция – дегидрирование глюкозо-6-фосфата при участии фермента глюкозо-6-фосфатдегидрогеназы и кофермента НАДФ+. Образовавшийся в ходе реакции 6-фосфоглюконо-δ-лактон – соединение нестабильное и с большой скоростью гидролизуется либо спонтанно, либо с помощью фермента 6-фосфоглюконо-лактоназы с образованием 6-фосфоглюко-новой кислоты (6-фосфоглюконат):


Во второй – окислительной – реакции, катализируемой 6-фосфоглюконатдегид-рогеназой (декарбоксилирующей), 6-фосфоглюконат дегидрируется и декарбок-силируется. В результате образуется фосфорилированная кетопентоза – D-рибулозо-5-фосфат и еще 1 молекула НАДФН:

Под действием соответствующей эпимеразы из рибулозо-5-фосфата может образоваться другая фосфопентоза – ксилулозо-5-фосфат. Кроме того, рибулозо-5-фосфат под влиянием особой изомеразы легко превращается в рибозо-5-фосфат. Между этими формами пентозофосфатов устанавливается состояние подвижного равновесия:
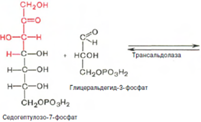

При определенных условиях пентозофосфатный путь на этом этапе может быть завершен. Однако при других условиях наступает так называемый неокислительный этап (стадия) пентозофосфатного цикла. Реакцииэтого этапа не связаны с использованием кислорода и протекают в анаэробных условиях. При этом образуются вещества, характерные для первой стадии гликолиза (фруктозо-6-фосфат, фруктозо-1,6-бисфосфат, фосфотриозы), а другие – специфические для пентозофосфатного пути (седогептулозо-7-фосфат, пентозо-5-фосфаты, эритрозо-4-фосфат). Основными реакциями неокислительной стадии пентозофосфатного цикла являются транскетолазная и трансальдолазная. Эти реакции катализируют превращение изомерных пентозо-5-фосфатов: 
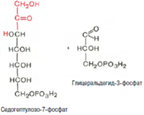
Коферментом в транскетолазной реакции служит ТПФ, играющий роль промежуточного переносчика гликольаль-дегидной группы от ксилулозо-5-фосфата к рибозо-5-фосфату. В результате образуется семиуглеродный моносахарид седогептулозо-7-фосфат и глицеральдегид-3-фосфат. Транскетолазная реакция в пентозном цикле встречается дважды, второй раз – при образовании фруктозо-6-фосфата и триозофосфата в результате взаимодействия второй молекулы ксилулозо-5-фосфата с эритрозо-4-фосфатом: 
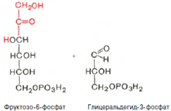
Фермент трансальдолаза катализирует перенос остатка диоксиацетона (но не свободного диоксиацетона) от седогептулозо-7-фосфата на глицеральдегид-3-фосфат:
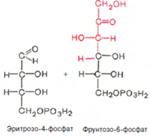
В реакции его вступают 6 молекул глюкозо-6-фосфата. Одна из них полность расщепляется до 6 молекул углекислого газа, 12 ионов водорода, восстанавливающих 6 молекул НАДФ. Остальные молекулы глюкозо-6-фосфата окисляются до 6 молекул пентозо-3-фосфатов: рибозо-5-фосфата, рибулозо-5-фосфата и ксилулозо-3-фосфата. В результате взаимодействия 6 молекул пентозо-3-фосфатов между собой образуется 5 молекул глюкозо-6-фосфата.
55. Биологическая роль пентозного цикла. В реакции его вступают 6 молекул глюкозо-6-фосфата. Одна из них полность расщепляется до 6 молекул углекислого газа, 12 ионов водорода, восстанавливающих 6 молекул НАДФ. Остальные молекулы глюкозо-6-фосфата окисляются до 6 молекул пентозо-3-фосфатов: рибозо-5-фосфата, рибулозо-5-фосфата и ксилулозо-3-фосфата. В результате взаимодействия 6 молекул пентозо-3-фосфатов между собой образуется 5 молекул глюкозо-6-фосфата. В реакциях окислительной ветви этого метаболического пути генерируется рибозо-5-фосфат, необходимый для биосинтеза нуклеотидов нуклеиновых кислот, АТФ, НАД,ФАД, витамина В12 и других веществ. Генерирующийся в реакциях пентозного цикла НАДФ-Н2 используется не в процессах энергообеспечения, а в реакциях биосинтеза жирных кислот, холестерола и других веществ. НАДФ-Н2 применяется также в реакция гидроксилирования эндогенных и чужеродных соединений, протекающих в цепи перенося электронов с участием цитохрома Р450, расположенной на мембрагнах эндоплазматического ретикулума. НАДФ-Н2 принимает участие в восстановлении глутатиондисульфида, образовавшегося в реакциях обезвреживания перекисных и других токсических соединений.
56. Гидролиз липидов и всасывание аго продуктов в органах пищеварительной системы. Роль желчных кислот. В ротовой полости пищевой комок лишь измельчается. В желудке молодняка имеется липаза расщепляющая ацилглицеролы при РН 5,5. У взрослы животных рН ниже и активность этого фермента тормозится. Липиды поступают в 12-персную кишку, содержимое которого приобретает слабо щелочную реакцию. Здесь они расщепляются липазой, поступившей из поджелудочной железы.

Этому способствуют желчные кислоты, образующиеся в печени из холестерола и образующие комплексные соединения с ацилглицеролами. Секрецию желчных кислот из желчного пузыря усиливает холецистокинин, вырабатываемый стенкой кишечника. Желчные кислоты эмульгируют жиры, увеличивая площадь соприкосновения их с ферментом, активируют липазу. Отщепившиеся от ацилглицеролов жирные кислоты не растворимы в воде и поэтому образуют растворимые комплексы с желчными кислотами (холеиновые кислоты). В стенке кишечника они расщепляются и жирные кислоты всасываются. Фосфоглицериды, поступившие с пищей, в 12-персной кишке расщепляются фосфолипазами А1, А2, С и D, а эфиры холестерола и жирных кислот – холестеразой. В стенке кишечника из глицерола и жирных кислот синтезируются эндогенные ацилглицеролы. Они соединяются с холестерином, окружаются слоями из фосфоглицеридов и белков, образуя транспортные липопротеины, и поступают в кровь. Транспорт липидов кровью. Различают 4 разновидности транспортных липопротеинов, поступающих в кровь из стенки тонкого кишечника и печени: хиломикроны, пре-β-, β- и α-липопротеины. Наиболее высокое соотношение между уровнем в крови липидов и белков отмечается у хиломикронов, наиболее низкое – у α-липопротеинов (липоротеинов высокой плотности. У пре-β- β-липопротеинов (липоротеинов низкой плотности) оно занимает промежуточное положение. Содержание последних в сыворотке крови увеличивается при атеросклерозе. Транспортные липопротеины током крови доставляются в печень, глее расщепляются липопротеинлипазой. Освободившиеся глицерол и жирные кислоты окисляются.
57. Транспорт липидов кровью. Транспортные липопротеины. В ротовой полости пищевой комок лишь измельчается. В желудке молодняка имеется липаза расщепляющая ацилглицеролы при РН 5,5. У взрослы животных рН ниже и активность этого фермента тормозится. Липиды поступают в 12-персную кишку, содержимое которого приобретает слабо щелочную реакцию. Здесь они расщепляются липазой, поступившей из поджелудочной железы.

Этому способствуют желчные кислоты, образующиеся в печени из холестерола и образующие комплексные соединения с ацилглицеролами. Секрецию желчных кислот из желчного пузыря усиливает холецистокинин, вырабатываемый стенкой кишечника. Желчные кислоты эмульгируют жиры, увеличивая площадь соприкосновения их с ферментом, активируют липазу. Отщепившиеся от ацилглицеролов жирные кислоты не растворимы в воде и поэтому образуют растворимые комплексы с желчными кислотами (холеиновые кислоты). В стенке кишечника они расщепляются и жирные кислоты всасываются. Фосфоглицериды, поступившие с пищей, в 12-персной кишке расщепляются фосфолипазами А1, А2, С и D, а эфиры холестерола и жирных кислот – холестеразой. В стенке кишечника из глицерола и жирных кислот синтезируются эндогенные ацилглицеролы. Они соединяются с холестерином, окружаются слоями из фосфоглицеридов и белков, образуя транспортные липопротеины, и поступают в кровь. Транспорт липидов кровью. Различают 4 разновидности транспортных липопротеинов, поступающих в кровь из стенки тонкого кишечника и печени: хиломикроны, пре-β-, β- и α-липопротеины. Наиболее высокое соотношение между уровнем в крови липидов и белков отмечается у хиломикронов, наиболее низкое – у α-липопротеинов (липоротеинов высокой плотности. У пре-β- β-липопротеинов (липоротеинов низкой плотности) оно занимает промежуточное положение. Содержание последних в сыворотке крови увеличивается при атеросклерозе. Транспортные липопротеины током крови доставляются в печень, глее расщепляются липопротеинлипазой. Освободившиеся глицерол и жирные кислоты окисляются.
58. Бета-окисление жирных кислот. С наибольшей интенсивностью этот процесс протекает в печени, где жирные кислоты окисляются до ацетил-КоА. В сердце и других органах они способны окисляться до углекислого газа и воды. Протекает β-окисление жирных кислот в пространстве между внутренней и наружной мембранами митохондрий. Начинается оно с активирования молекулы жирной кислоты:
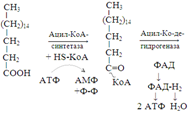
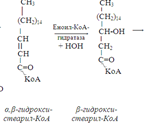
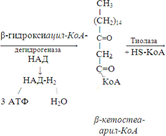
Так завершается один цикл β-окисления жирной кислоты, во время которого генерируется по одной молекуле ФАД-Н2 и НАД-Н2, окисляемых в дыхательной цепи митохондрий, и ацетил-КоА, способного окисляться в цикле Кребса. Укоротившийся на 2 углеродных фрагмента активированный остаток пальмитиновой кислоты (ацил-КоА) таким же образом, цикл за циклом, подвергается дальнейшему β-окислению. На последнем этапе этого процесса образуется активная форма масляной кислоты (бутирил-КоА). Она также подвергается β-окислениию.
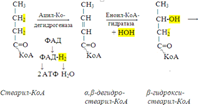
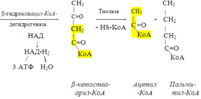
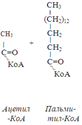
Из этого четырехуглеродной активированной жирной кислоты генерируется 2 молекулы ацетил- КоА, но не по две, а по одной молекуле ФАД-Н2 и НАД-Н2 (образовавшаяся молекула ацетил- КоА не подвергается дальнейшему β-окислению). Энергетический эффект β-окисления жирных кислот(Х)рассчитывается по формуле: Х = n/2 X 17 – (5-1), где n – число углеродных атомов, включая группу –СООН; 17 – число молекул АТФ, генерируемых во время одного цикла: при окислении ФАД-Н2 (2 АТФ),НАД-Н2 (3 АТФ) и ацетил-КоА в цикле Кребса.(12 АТФ); 5 – количество АТФ, не образовашегося на последнем этапе β-окисления; 1 – количество АТФ, затрачиваемое на активацию жирной кислоты (образование ацил-КоА). β-окисления жирных кислот в печени. В этом органе основная масса жирных кислот окисляется до ацетил-КоА. Две молекулы последнего последнего соединяются между собой в результате реакции, катализируемой тиолазой. Образовавшаяся ацетоуксусная кислота током крови доставляется в мышечную и другие ткани, где обратно расщепляется до ацетил-КоА, который окисляется в цикле Кребса. Часть молекул ацетоуксусной кислоты, восстанавливаясь ионами водорода, отщепляемыми от НАД-Н2, превращается в β-гидрооксимасляную килоту. Какое-то количество молекул ацетоуксусной кислоты, отщепляя от карбоксильной группы углекислый газ, превращается в ацетон. Общее количество ацетоуксусной, β-гидрооксимасляной кислот и ацетона называют кетоновыми телами. Количество последних в тканях увеличивается (кетоз) при усиленном образовании их и недостаточно эффективном окислении. Окисление пропионовой кислоты, образовавшейся в рубце при расщеплении микроорганизмами клетчатки. Сукцинил-КоА в дальнейшем окисляется в цикле Кребса.
59. Механизм образования и окисления кетоновых тел. Под термином «кетоновые (ацетоновые) тела» подразумевают ацетоуксусную кислоту (ацетоацетат) СН3СОСН2СООН, β-оксимасляную кислоту (β-оксибутират, или D-3-гидроксибутират) СН3СНОНСН2СООН и ацетон СН3СОСН3. В здоровом организме ацетон в крови присутствует в крайне низких концентрациях, образуется в результате спонтанного декарбоксили-рования ацетоацетата и, по-видимому, не имеет определенного физиологического значения. Кетоновые тела образуются в печени. Прежние представления о том, что кетоновые тела являются промежуточными про