А. Расщепление пептидазой фрагмента белковой молекулы из аланина, цистеина и триптофана.
34. Ферменты-гидролазы, расщепляю-щие ацилглицеролы. Такие ферменты называют липазами. Липаза, КФ 3.1.1.3, стеапсин, триацил-глицерол-ацилгидролаза,
E1104. Водорастворимый фермент, который катализирует гидролиз нерастворимых эстеров - липидных субстратов, помогая переваривать, растворять и фракционировать жиры. Панкреатическая липаза имеет молекулярную массу 48 000 единиц, в катали-тическом центре содержит остаток гистидина и серина. По классифика-ции ферментов липазы относятся к эстеразам. Вырабатывается рядом органов и тканей - в слюнных железах, поджелудочной железе, печени, легких, кишечнике. Липаза желудка расщепляет трибути-рины масла; играет второстепенную роль. Липаза поджелудочной железы является важнейшим ферментом в переваривании жиров. Она действует на жиры (триглицериды), предвари-тельно эмульгированные желчью, секретируемой в просвет кишечника печенью. Панкреатическая липаза выводится в двенадцатиперстную кишку в виде неактивного профермента - пролипазы. Активация пролипазы в активную липазу происходит под действием жёлчных кислот и другого фермента сока поджелудочной железы - колипазы. Лингвальная липаза вырабатывается расположенными во рту железами у детей грудного возраста. Ее функция заключается в расщеплении жиров грудного молока. Печёночная липаза секретируется в кровь и связывается со стенками сосудов печени. Она расщепляет липопротеины очень низкой плотности и хиломикроны. Слюна взрослого человека не содержит ферментов, расщеп-ляющих липиды и их продукты, поэтому переваривание жиров начинается в желудке под действием липазы желудочного сока. Расщепление триацилглицеролов в желудке взрослого человека невелико, однако образовав-шиеся соли жирных кислот являются активным эмульга-тором жиров. Основная масса пищевых жиров расщепляется в тонкой кишке при участии липазы сока поджелудочной железы. Панкреатическая липаза является гликопротеидом, легче всего расщепляющим эмульги-рованные триацилгицеролы в щёлочной среде с рН = 8-9. Панкреатическая липаза катализирует в полости тонкой кишки разложение жиров пищи (триглицеридов) на глицерин и высшие жирные кислоты, образуя сначала 1.2 и 2.3-диглицериды, а затем 2-моноглицериды. У детей грудного возраста в секрете глоточных желез содержится лингвальная липаза, которая участвует в перева-ривании грудного молока. Оптимальной средой для максимального действия лингвальной липазы является среда с кислотностью приблизи-тельно равной кислотности желудочного сока грудных детей, pH = 4,0-5,0.
а. Гидролиз липазой тристеарина.
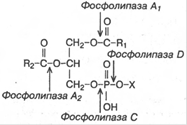
34б. Гидролиз фосфолипазами А1, А2, С и Dфосфоглицеридов. Фосфолипаза A1 атакует эфирную связь фосфолипидов в положении 1. Фосфолипаза А2 катализирует гидролиз эфирной связи в положении 2 глицерофосфолипидов, в результате чего образуются свободная жирная кислота и лизофосфолипид (в случае фосфатидилхолина – лизолецитин), который реацилируется ацил-КоА при участии ацилтрансферазы. Фосфолипаза С атакует эфирную связь в положении 3, что заканчивается образованием 1,2-диглицерида и фосфорильного основания. Фосфолипаза D катализирует отщепление от фосфолипида азотистого основания. Долгое время считалось, что фосфолипаза D содержится только растительных тканях. В последнее время ее удалось обнаружить в растворимой фракции мозга крысы, а затем в микросомах мозга и других органов, а в самое последнее время-в митохондриях печени крысы. Нет ясности в отношении фосфолипазы В. Возможно, что это-смесь
ферментов, обладающих свойствами фосфолипаз А1 и А2. Не исключено, что фосфолипаза В-фермент, действующий только на лизофосфолипид (например, лизолецитин), т.е. это лизофосфолипаза.
35. Ферменты-гидролазы, расщепляю-шие углеводы. Гликозидазы катализируют гидролиз гликозидных связей в молекулах углеводов, приводя к появлению двух более мелких молекул углеводов. Эти ферменты встречаются в клетках почти всех живых организмов. Гликозидазы выполняют множество разнообразных функций: деградация биомассы (например, целлюлозы и гемицеллюлозы), участие в антибактериальной защите организма (например, лизоцим), развитие патогенеза (например, вирусные нейраминидазы), клеточный биосинтез (например, маннозидазы, вовлечённые в созревание N-гликозилированных гликопротеинов). Гли-козидазы вместе с гликозилтрансферазами образуют основу биологического аппарата синтеза и разрушения гликозидных связей. Гликозил-гидролазы объединены в КФ 3.2.1 как ферменты, катализирующие гидролиз O- или S-гликозидов. Все гликозидазы имеют номера КФ 3.2.1.x, при этом x может быть от 1 до 165 в зависимости от субстратной специфичности фермента. На основе молекулярного механизма катализируемой ими реакции гликозидазы могут быть разбиты на две группы. Представители одной из них обращают (inverting), а другой — сохраняют (retaining) путём двойного обращения аномерную конфигурацию субстрата у продукта реакции гидролиза. Гликозил-гидролазы также могут быть классифицированы как экзо- или эндо-действующие, в зависимости от того, действуют ли они соответственно на концевой или внутренний моносахаридный остаток в углеводной цепи. Более современные классификации гликозил-гидролаз основаны на сравнении их аминокислотных последовательностей.
36. Ферменты-изомеразы. К классу изомераз относят ферменты, катализирующие взаимопревращения оптических и геометрических изомеров. Систематическое название их составляют с учетом типа реакции: «субстрат – цистранс-изомераза». Если изомеризация включает внутримолекулярный перенос группы, фермент получает название «мутаза». К этому же классу относят рацемазы и эпимеразы, действующие на амино- и оксикислоты, углеводы и их производные; внутримолекулярные оксидоредуктазы, катализирующие взаимопревращения альдоз и кетоз; внутримолекулярные трансферазы, переносящие ацильные, фосфорильные и другие группы, и т.д.

37. Ферменты-лиазы. К классу лиаз относят ферменты, катализирующие разрыв связей С—О, С—С, С—N и других, а также обратимые реакции отщепления различных групп от субстратов не гидролитическим путем. Эти реакции сопровождаются образованием двойной связи или присоединением групп к месту разрыва двойной связи. Ферменты обозначают термином «субстрат-лиазы». Например, фумарат-гидратаза (систематическое название «L-малат-гидролаза») катали-зирует обратимое отщепление молекулы воды от яблочной кислоты с образованием фумаровой кислоты. В эту же группу входят декарбоксилазы (карбокси-лиазы), амидин-лиазы и др.
38. Ферменты-лигазы (синтетазы). К классу лигаз относят ферменты, катализирующие синтез органических веществ из двух исходных молекул с использованием энергии распада АТФ (или другого нуклеозидтрифосфата). Системати-ческое название их составляют по форме «X: Y лигаза», где X и Y обозначают исходные вещества. В качестве примера можно назвать L-глутамат: аммиак лигазу (рекомендуемое сокращенное название «глутаминсинтетаза»), при участии которой из глутаминовой кислоты и аммиака в при-сутствии АТФ синтезируется глутамин.
39. Активаторы и игибиторы ферментов. Скорость ферментативной реакции и активность фермента определяется присутствием в среде активаторов и ингибиторов: первые повышают скорость реакции, а вторые тормозят эту реакцию. Так, соляная кислота активирует действие пепсина желудочного сока; желчные кислоты повышают активность панкреатической липазы; некоторые тканевые ферменты (оксидоредуктазы, катепсины, аргиназа), растительная протеиназа и др. в значительной степени активируются соединениями, содержащими свободные SH-группы (глутатион, цистеин), а ряд ферментов – также витамином С. Особенно часто активаторами выступают ионы двухвалентных и, реже, одновалентных металлов. Около четверти всех известных ферментов для проявления полной каталитической активности нуждаются в присутствии металлов. Многие ферменты вообще не активны в отсутствие металлов. Так, при удалении цинка угольная ангидраза (карбоангидраза), катализиру-ющая биосинтез и распад Н2СО3, практически теряет свою ферментативную активность; более того, цинк при этом не может быть заменен никаким другим металлом. Известны ферменты, действие которых активируется ионами нескольких металлов; в частности, енолаза активируется Mg2+, Mn2+, К+. На активность фермента влияет концентрация субстрата. При увеличении последней активность фермента возрастает, но до определенного предела. Концентрация субстрата, при которой активность фермента равна 0,5 от максимальной, называется константой Михаэлиса. На активность фермента влияет концентрация продукта реакции. При постепенном накоплении последнего в среде она снижается. Поэтому активность фермента определяют на начальном этапе реакции, когда субстрат еще не накопился. Активность ферментов зависит от рН среды. В зависимости от рН изменяется диссоциация ионогенных групп в активном центре фермента и в молекуле субстрата, что влияет на скорость реакции. Большинство ферментов наиболее активны в слабощелочной среде. Исключение – пепсин желудочного сока и катепсины лизосом, активные в кислой среде. На активность фермента влияет температура среды. Обычно при повышении ее на 10оС скорость реакции увеличивается в 2 раза (правило Ван Гоффа). Наиболее активны ферменты млекопитающих при 40-50 о. При более низкой температуре активность тормозится из-за снижения диссоциации ионогенных групп, а при более высокой – из-за денатурации белковой молекулы.
Ингибиторы по характеру торможения активности фермента могут быть обратимыми и необратимыми. В первом случае комплекс фермент-ингибитор может расщепляться и активность фермента восстанавливается. При необратимом ингибировании образуется прочная связь между ферментом и ингибитором. По механизму действия ингибиторы делят на конкурентные, неконкурентные, субстрат-ные и аллостерические. При конкурентном ингибировании структура ингибитора близка к структуре субстрата и он конкурирует за активный центр. Например, малоновая кислота по структуре близка к янтарной кислоте и поэтому способна связывать активный центр сукцинатде-гидрогеназы. Ингибирование можно осла-бить увеличением концентрации субстрата. На конкурентном ингибировании основано действие сульфаниламидов. Они по строению сходны с п-аминобензойной кислотой, необходимой микроорганизмам. Сульфаниламиды, занимая место послед-ней, тормозят рост микроорганизмов. Неконкурентное ингибирование развивается под действием вещества, структура которого не сходная со структурой субстрата. Оно связывается не с активным центром, а с другими участками молекулы фермента. Последний после этого может образовывать комплекс с субстратом, но внутри этого комплекса реакция не протекает. Например, ионы тяжелых металлов связывают HS-группы ферментов, ингибируя их. Цианиды связываются с ионом железа цитохромоксидазы, прекращая дыхание митохондрий. Неконкурентное ингибирование, в отличие от конкурентного, не снимается избытком субстрата. в. Субстратное ингибирование развивается иногда при увеличении в среде концентрации субстрата. Его снимают, уменьшая концентрацию последнего. г. Аллостерическое ингибирование развива-ется тогда, когда вещество, сзязываясь с аллостерическим центром, изменяет конфигурацию активного центра, блокируя его. Такими ингибиторами могут быть собственный продукт реакции, продукты других реакций, гормоны и другие вещества.
40. Ферменты поджелудочной железы. Поджелудочная железа является уникальным органом человеческого организма, ведь вещества, которые она вырабатывает, участвуют в процессах пищеварения и усвоения питательных веществ, практически на всех этапах. Большая часть клеток этого органа вырабатывает сложный по составу пищеварительный сок, без ферментов которого невозможны процессы пищеварения в тонком кишечнике. Относительно небольшое количество клеток секретирует в кровь гормоны инсулин и глюкагон, которые участвуют в обмене углеродов и регуляции метаболических процессов практически во всех клетках организма, а также схожее по структуре с гормонами вещество липокаин, участвующее в регуляции некоторых биохимических процессах, происходящих в печени. В составе панкреатического сока, который вырабатывается внешнесек-реторными клетками поджелудочной железы, кроме жидкой его составляющей, есть небольшое количество слизи и ферменты, которые непосредственно участвуют в процессе переваривания пищи. К особенностям работы поджелудочной железы можно отнести тот факт, что некоторые ферментативные вещества, которые образуются в клетках, первона-чально синтезируются в неактивной форме и в таком виде выделяются в проток поджелудочной железы, через который они попадают в общий желчный проток и двенадцатиперстную кишку. Только в просвете кишечника происходит активизация неактивных ферментов – в противном случае панкреатический сок, компоненты которого отличаются высокой активностью, немедленно после выделения начинали бы переваривание ткани органа. Для активизации ферментов панкреати-ческого сока необходимо наличие в просвете двенадцатиперстной кишки достаточного количества желчи. Под влиянием желчи клетки слизистой начального отдела тонкого кишечника начинают вырабатывать фермент энтеро-киназу, которая превращает неактивную форму фермента трипсиноген в активный трипсин, а этот фермент в свою очередь активизирует остальные компоненты панкреатического сока. Непосредственно на процесс регуляции панкреатического сока влияют нервные и гуморальные механизмы, тогда как на его количественный и качественный состав в большей мере влияет состав пищи, которую употребляет человек. Активная выработка ферментов поджелудочной железы начинается непосредственно в момент попадания пищи в просвет кишечника – примерно через 2-3 минуты и продолжается в течение 10-14 часов. Поджелудочная железа является основной железой в системе пищеварения. Она секретирует ферменты в просвет двенадцатиперстной кишки. Протеазы: Трипсин является протеазой, аналогичной пепсину желудка. Химотрипсин — также протеаза, расщепляющая белки пищи. Карбоксипептидаза Несколько различных эластаз, расщепляющих эластин и некоторые другие белки. Нуклеазы, расщепляющие нуклеиновые кислоты ДНК и РНК. Стеапсин, расщепляющий жиры. Амилазу, расщепляющую крахмал и гликоген, а также другие углеводы. Липаза поджелудочной железы является важнейшим ферментом в переваривании жиров. Она действует на жиры (триглицериды), предварительно эмульги-рованные желчью, секретируемой в просвет кишечника печенью.
41. Обмен веществ: определение, основные этапы. Обмен веществ – совокупность химических превращений, которым подвергаются вещества с момента поступления в организм до выделения их в виде конечных продуктов. Включает два взаимосвязанные между собой процессы: ассимиляцию и диссимиляцию. Ассимиляция – образование характерных для организма веществ, сопряженное с потреблением АТФ. Диссимиляция – процесс распада веществ в организме. Этапы обмена веществ: 1. Пищеварение – гидролитическое расщепление ферментами веществ, поступивших с пищей, до простых веществ- мономеров: белки расщепляются до аминокислот, жиры – до глицерина и жирных кислот, олиго- и полисахахариды – до моносахаридов. 2. Всасывание мономеров в кровь в стенке кишечника. 3. Межуточный (тканевой) обмен – химические превращения веществ в тканях или метаболизм. Вещества, участвующие в этих превращениях – метаболиты. Одновременно в организме протекают процессы образования (анаболизм) и распада веществ (катаболизм). 4. Образование конечных продуктов - процесс, позволяющий высвободить около 80% энергии. Конечными продуктами метаболизма белков, углеводов и липидов являются углекислый газ и вода. При окислении белков образуется также аммиак, обезвреживающийся в мочевину.
42. Структура и биологическая роль АТФ. Фосфорилирование окислительное и субстратное. Биологическое окисление – совокупность процессов окисления (отщепления и присоединения электронов), протекающих в клетках. Согласно теории В.И. Палладина оно заключается в отщеплении от окисляемого субстрата ионов водорода и электронов и переносе их на активированный кислород с образованием воды: S-H2 2Н+ + 2е- ½ О2 → Н2О + энергия (210 кДж).
Реакция 2Н+ + ½ О2 → Н2О + энергия является основным источником энергии в организме. Вне организма она протекает быстро, с выделением большого количества энергии, с взрывом, а в организме – ступенчато. Энергия при этом выделяется порциями, что предотвращает перегревание клетки. Часть ее выделяется в виде тепла, часть запасается в макроэргических связях аденозинтрифосфата (АТФ): Аденозиндифосфат (АДФ) + Н3РО4 + энергия → АТФ.

Синтез АТФ из АДФ и Н3РО4 называется фосфорилированием. Различают две разнолвидности его: субстратное и окислительное фосфорилирование. Первое из них (субстратное фосфорилирование) протекает за счет энергии, освобождающейся при расщеплении макроэргических (богатых энергией) химических связей некоторых веществ- субстратов: 1,3-дифосфоглицериновой, фосфоенолпировиноградной кислот (в реакциях окисления глюкозы) и активной формы янтарной кислоты (в реакциях окисления активной формы уксусной кислоты в цикле Кребса); 2) за счет энергии освобождающейся при окислении кислородом ионов водорода ферментами дыхательной цепи, расположенной на внутренней мембране митохондрий (окислительное фосфорилирование).