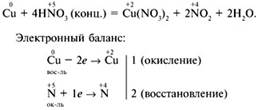Тема: Азотная кислота. Соли азотной кислоты.
(в дополнение к материалу параграфа №31)
Как всегда, нас интересует: состав вещества, свойства вещества (и физические и химические), способы получения, применение.
HNO3 - Азотная кислота
Степень окисления азота +5, а валентность равна IV.
Физические свойства
Азотная кислота HNO3 в чистом виде - бесцветная жидкость с резким удушливым запахом, неограниченно растворимая в воде. В небольших количествах она образуется при грозовых разрядах и присутствует в дождевой воде.
Под действием света азотная кислота частично разлагается с выделением NО2 и за cчет этого приобретает светло-бурый цвет:
N2 + O2 грозовые эл.разряды→ 2NO
2NO + O2 → 2NO2
4НNО3 свет→ 4NО2↑ (бурый газ) + 2Н2О + О2
Азотная кислота высокой концентрации выделяет на воздухе газы, которые в закрытой бутылке обнаруживаются в виде коричневых паров (оксиды азота). Эти газы очень ядовиты, так что нужно остерегаться их вдыхания. Азотная кислота окисляет многие органические вещества. Бумага и ткани разрушаются вследствие окисления образующих эти материалы веществ. Концентрированная азотная кислота вызывает сильные ожоги при длительном контакте и пожелтение кожи на несколько дней при кратком контакте. То есть – это ожог кожи. Чтобы предотвратить ожог, следует работать с концентрированной азотной кислотой в резиновых перчатках.
Получение
1. Лабораторный способ
KNO3 + H2SO4(конц) → KHSO4 + HNO3 (при нагревании)
2. Промышленный способ
Осуществляется в три этапа:
a) Окисление аммиака на платиновом катализаторе до NO
4NH3 + 5O2 → 4NO + 6H2O (Условия: катализатор – Pt, t = 500˚С)
б) Окисление кислородом воздуха NO до NO2
2NO + O2 → 2NO2
в) Поглощение NO2 водой в присутствии избытка кислорода
4NO2 + О2 + 2H2O ↔ 4HNO3
или 3NO2 + H2O ↔ 2HNO3+NO (без избытка кислорода)
Применение
- в производстве минеральных удобрений;
- в военной промышленности;
- в фотографии — подкисление некоторых тонирующих растворов;
- в станковой графике — для травления печатных форм (офортных досок, цинкографических типографских форм и магниевых клише).
- в производстве взрывчатых и отравляющих веществ
ХИМИЧЕСКИЕ СВОЙСТВА
А) ОБЩИЕ С ДРУГИМИ КИСЛОТАМИ
1. Очень сильная кислота. Индикаторы в её растворе изменяют цвет на красный.
Диссоциирует в водном растворе практически нацело:
HNO3 → H+ + NO3-
Изменение цветов индикаторов в кислотах
2. Реагирует с основными оксидами
K2O + 2HNO3 → 2KNO3 + H2O
K2O + 2H+ + 2NO3- → 2K+ + 2NO3- + H2O
K2O + 2H+ → 2K+ + H2O
3. Реагирует с основаниями
HNO3 + NaOH → NaNO3 + H2O
(Ионные уравнения написать самим!)
4. Реагирует с солями, вытесняет слабые кислоты из их солей
2HNO3 + Na2CO3 → 2NaNO3 + H2O + CO2
(Ионные уравнения написать самим!)
СПЕЦИФИЧЕСКИЕ СВОЙСТВА АЗОТНОЙ КИСЛОТЫ
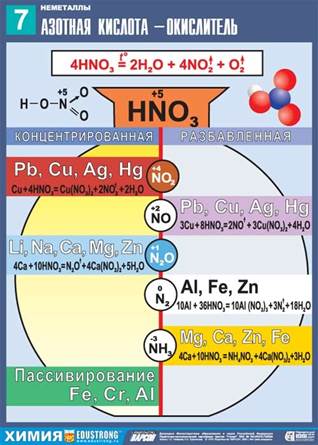
Азотная кислота - сильный окислитель
N+5 → N+4→ N+2→ N+1→ No → N-3
N+5 + 8e-→N-3 окислитель, восстанавливается.
1. Разлагается на свету и при нагревании
4HNO3 → 2H2O + 4NO2 + O2
Образуется бурый газ
2. Реагирует с металлами. При этом образуются всегда соль металла +вода+соединение азота (которое зависит от активности металла и концентрации кислоты)
В зависимости от концентрации кислоты и положения металла в электрохимическом ряду напряжений Н. Бекетова могут образовываться разные азотсодержащие продукты.
 Царская водка: V(HNO3): V(HCl) = 1: 3 растворяет благородные металлы.
HNO3 + 4HCl + Au = H[AuCl4] + NO + 2H2O
4HNO3 + 18HCl + 3Pt = 3H2[PtCl6] + 4NO + 8H2O
3. Реагирует с неметаллами.
Азотная кислота превращается в NO (или в NO2); неметаллы окисляются до соответствующих кислот:
S0 + 6HNO3(конц) → H2S+6O4 + 6NO2 + 2H2O
B0 + 3HNO3 → H3B+3O3 + 3NO2
3P0 + 5HNO3 + 2H2O → 5NO + 3H3P+5O4
HNO3 (конц.) + неметалл = окисление неметалла до кислоты в высшей степени окисления + NO2 + вода
HNO3 (разбав.) + неметалл + вода = окисление неметалла до кислоты в высшей степени окисления + NO
Царская водка: V(HNO3): V(HCl) = 1: 3 растворяет благородные металлы.
HNO3 + 4HCl + Au = H[AuCl4] + NO + 2H2O
4HNO3 + 18HCl + 3Pt = 3H2[PtCl6] + 4NO + 8H2O
3. Реагирует с неметаллами.
Азотная кислота превращается в NO (или в NO2); неметаллы окисляются до соответствующих кислот:
S0 + 6HNO3(конц) → H2S+6O4 + 6NO2 + 2H2O
B0 + 3HNO3 → H3B+3O3 + 3NO2
3P0 + 5HNO3 + 2H2O → 5NO + 3H3P+5O4
HNO3 (конц.) + неметалл = окисление неметалла до кислоты в высшей степени окисления + NO2 + вода
HNO3 (разбав.) + неметалл + вода = окисление неметалла до кислоты в высшей степени окисления + NO
Соли азотной кислоты - Нитраты (селитры)
Азотная кислота – одноосновная, образует один ряд солей – нитраты состава:
Нитраты калия, натрия, кальция и аммония называют селитрами. Например, селитры: KNO3 – нитрат калия (индийская селитра), NаNО3 – нитрат натрия (чилийская селитра), Са(NО3)2 – нитрат кальция (норвежская селитра), NH4NO3 – нитрат аммония (аммиачная или аммонийная селитра, ее месторождений в природе нет). Германская промышленность считается первой в мире, получившей соль NH4NO3 из азота N2 воздуха и водорода воды, пригодную для питания растений.
Физические свойства
Нитраты – вещества с преимущественно ионным типом кристаллических решёток. При обычных условиях это твёрдые кристаллические вещества, все нитраты хорошо растворимы в воде, сильные электролиты.
Получение нитратов
Нитраты образуются при взаимодействии:
1) Металл + Азотная кислота
Cu + 4HNO3(k) = Cu(NO3)2 + 2NO2↑ + 2H2O
2) Основный оксид + Азотная кислота
CuO + 2HNO3 = Cu(NO3)2 + H2O
3) Основание + Азотная кислота
HNO3 + NaOH = NaNO3 + H2O
4) Аммиак + Азотная кислота
NH3 + HNO3 = NH4NO3
5) Соль слабой кислоты + Азотная кислота
2HNO3 + Na2CO3 = 2NaNO3 + H2O + CO2 ↑
6) Оксид азота (IV) + щёлочь
2NO2 + NaOH = NaNO2 + NaNO3 + H2O
в присутствии кислорода -
4NO2 + O2 + 4NaOH = 4NaNO3 + 2H2O
Химические свойства нитратов
I. Общие с другими солями
1) C металлами
Металл, стоящий в ряду активности левее, вытесняет последующие из их солей:
Cu(NO3)2 + Zn = Cu + Zn(NO3)2
2) С кислотами
AgNO3 + HCl = AgCl↓ + HNO3
3) Со щелочами
Cu(NO3)2 + 2NaOH = Cu(OH)2 ↓ + 2NaNO3
4) C cолями
2AgNO3 + BaCl2 = Ba(NO3)2 + 2AgCl↓
II. Специфические
Все нитраты термически неустойчивы. При нагреванииони разлагаютсяс образованием кислорода. Характер других продуктов реакции зависит от положения металла, образующего нитрат, в электрохимическом ряду напряжений:
 1) Нитраты щелочных (исключение - нитрат лития) и щелочноземельных металлов разлагаются до нитритов:
2NaNO3 = 2NaNO2 + O2↑
2КNO3 = 2KNO2 + O2
2) Нитраты менее активных металлов от Mg до Cuвключительно и нитрат лития разлагаются до оксидов:
2Mg(NO3)2 = 2MgO + 4NO2↑ + O2↑
2Cu(NO3)2 =2CuO + 4NO2 ↑+ O2↑
3) Нитраты наименее активных металлов (правее меди) разлагаются до металлов:
Hg(NO3)2 = Hg + 2NO2↑ + O2↑
2AgNO3 = 2Ag + 2NO2 ↑+ O2↑
4) Нитрат и нитрит аммония:
Нитрат аммония разлагается в зависимости от температуры так:
NH4NO3 = N2O ↑+ 2H2O (190-245°C)
2NH4NO3 = N2↑ + 2NO + 4H2O (250-300°C)
2NH4NO3 = 2N2 ↑+ O2 + 4H2O (выше 300°C)
Нитрит аммония:
NH4NO2 = N2 ↑+ 2H2O
Дополнительно:
Исключения:
4LiNO3 = 2Li2O + 4NO2 + O2
Mn(NO3)2=MnO2 + 2NO2
4Fe(NO3)2=2Fe2O3 + 8NO2 + O2
Качественная реакция на нитрат-ион NO3– – взаимодействие нитратов c металлической медью при нагревании в присутствии концентрированной серной кислоты..
Признаки реакции - в пробирке появляются бурые пары оксида азота(IV), что лучше наблюдать на белом экране, а на границе медь – реакционная смесь появляются зеленоватые кристаллы нитрата меди(II).
Протекают следующие уравнения реакций:
КNO3 (кр.) + Н2SO4 (конц.) = КНSО4 + НNО3↑
1) Нитраты щелочных (исключение - нитрат лития) и щелочноземельных металлов разлагаются до нитритов:
2NaNO3 = 2NaNO2 + O2↑
2КNO3 = 2KNO2 + O2
2) Нитраты менее активных металлов от Mg до Cuвключительно и нитрат лития разлагаются до оксидов:
2Mg(NO3)2 = 2MgO + 4NO2↑ + O2↑
2Cu(NO3)2 =2CuO + 4NO2 ↑+ O2↑
3) Нитраты наименее активных металлов (правее меди) разлагаются до металлов:
Hg(NO3)2 = Hg + 2NO2↑ + O2↑
2AgNO3 = 2Ag + 2NO2 ↑+ O2↑
4) Нитрат и нитрит аммония:
Нитрат аммония разлагается в зависимости от температуры так:
NH4NO3 = N2O ↑+ 2H2O (190-245°C)
2NH4NO3 = N2↑ + 2NO + 4H2O (250-300°C)
2NH4NO3 = 2N2 ↑+ O2 + 4H2O (выше 300°C)
Нитрит аммония:
NH4NO2 = N2 ↑+ 2H2O
Дополнительно:
Исключения:
4LiNO3 = 2Li2O + 4NO2 + O2
Mn(NO3)2=MnO2 + 2NO2
4Fe(NO3)2=2Fe2O3 + 8NO2 + O2
Качественная реакция на нитрат-ион NO3– – взаимодействие нитратов c металлической медью при нагревании в присутствии концентрированной серной кислоты..
Признаки реакции - в пробирке появляются бурые пары оксида азота(IV), что лучше наблюдать на белом экране, а на границе медь – реакционная смесь появляются зеленоватые кристаллы нитрата меди(II).
Протекают следующие уравнения реакций:
КNO3 (кр.) + Н2SO4 (конц.) = КНSО4 + НNО3↑
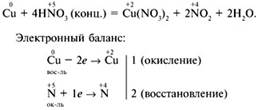
| Вопросы для контроля:
№1. Степень окисления атома азота в молекуле азотной кислоты
a. +4 b. +3
c. +5
№2. Атом азота в молекуле азотной кислоты имеет валентность равную -
a. II b. V
c. IV d. III
№3. Какими физическими свойствами характеризуют чистую азотную кислоту?
a. без цвета b. не имеет запаха
c. имеет резкий раздражающий запах
d. дымящая жидкость e. окрашена в жёлтый цвет
№4. Установите соответствие между исходными веществами и продуктами реакции:
| a) NH3 + O2
| 1) NO2
| | b) KNO3 + H2SO4
| 2) NO2 + О2 + H2O
| | c) HNO3
| 3) NO + H2O
| | d) NO + O2
| 4) KHSO4 + HNO3
| №5. Расставьте коэффициенты методом электронного баланса, покажите переход электронов, укажите процессы окисления (восстановления); окислитель (восстановитель):
NO2 + О2 + H2O ↔ HNO3
|
№6 Осуществите превращения по схеме, назовите вещества, первое уравнение разберите с точки зрения электронного баланса, а для второй реакции напишите полное и сокращенное ионные уравнения:
NH4Cl→ NH3 → N2 → NO → NO2 → HNO3 → NO2
 Царская водка: V(HNO3): V(HCl) = 1: 3 растворяет благородные металлы.
HNO3 + 4HCl + Au = H[AuCl4] + NO + 2H2O
4HNO3 + 18HCl + 3Pt = 3H2[PtCl6] + 4NO + 8H2O
3. Реагирует с неметаллами.
Азотная кислота превращается в NO (или в NO2); неметаллы окисляются до соответствующих кислот:
S0 + 6HNO3(конц) → H2S+6O4 + 6NO2 + 2H2O
B0 + 3HNO3 → H3B+3O3 + 3NO2
3P0 + 5HNO3 + 2H2O → 5NO + 3H3P+5O4
HNO3 (конц.) + неметалл = окисление неметалла до кислоты в высшей степени окисления + NO2 + вода
HNO3 (разбав.) + неметалл + вода = окисление неметалла до кислоты в высшей степени окисления + NO
Царская водка: V(HNO3): V(HCl) = 1: 3 растворяет благородные металлы.
HNO3 + 4HCl + Au = H[AuCl4] + NO + 2H2O
4HNO3 + 18HCl + 3Pt = 3H2[PtCl6] + 4NO + 8H2O
3. Реагирует с неметаллами.
Азотная кислота превращается в NO (или в NO2); неметаллы окисляются до соответствующих кислот:
S0 + 6HNO3(конц) → H2S+6O4 + 6NO2 + 2H2O
B0 + 3HNO3 → H3B+3O3 + 3NO2
3P0 + 5HNO3 + 2H2O → 5NO + 3H3P+5O4
HNO3 (конц.) + неметалл = окисление неметалла до кислоты в высшей степени окисления + NO2 + вода
HNO3 (разбав.) + неметалл + вода = окисление неметалла до кислоты в высшей степени окисления + NO
 1) Нитраты щелочных (исключение - нитрат лития) и щелочноземельных металлов разлагаются до нитритов:
2NaNO3 = 2NaNO2 + O2↑
2КNO3 = 2KNO2 + O2
2) Нитраты менее активных металлов от Mg до Cuвключительно и нитрат лития разлагаются до оксидов:
2Mg(NO3)2 = 2MgO + 4NO2↑ + O2↑
2Cu(NO3)2 =2CuO + 4NO2 ↑+ O2↑
3) Нитраты наименее активных металлов (правее меди) разлагаются до металлов:
Hg(NO3)2 = Hg + 2NO2↑ + O2↑
2AgNO3 = 2Ag + 2NO2 ↑+ O2↑
4) Нитрат и нитрит аммония:
Нитрат аммония разлагается в зависимости от температуры так:
NH4NO3 = N2O ↑+ 2H2O (190-245°C)
2NH4NO3 = N2↑ + 2NO + 4H2O (250-300°C)
2NH4NO3 = 2N2 ↑+ O2 + 4H2O (выше 300°C)
Нитрит аммония:
NH4NO2 = N2 ↑+ 2H2O
Дополнительно:
Исключения:
4LiNO3 = 2Li2O + 4NO2 + O2
Mn(NO3)2=MnO2 + 2NO2
4Fe(NO3)2=2Fe2O3 + 8NO2 + O2
Качественная реакция на нитрат-ион NO3– – взаимодействие нитратов c металлической медью при нагревании в присутствии концентрированной серной кислоты..
Признаки реакции - в пробирке появляются бурые пары оксида азота(IV), что лучше наблюдать на белом экране, а на границе медь – реакционная смесь появляются зеленоватые кристаллы нитрата меди(II).
Протекают следующие уравнения реакций:
КNO3 (кр.) + Н2SO4 (конц.) = КНSО4 + НNО3↑
1) Нитраты щелочных (исключение - нитрат лития) и щелочноземельных металлов разлагаются до нитритов:
2NaNO3 = 2NaNO2 + O2↑
2КNO3 = 2KNO2 + O2
2) Нитраты менее активных металлов от Mg до Cuвключительно и нитрат лития разлагаются до оксидов:
2Mg(NO3)2 = 2MgO + 4NO2↑ + O2↑
2Cu(NO3)2 =2CuO + 4NO2 ↑+ O2↑
3) Нитраты наименее активных металлов (правее меди) разлагаются до металлов:
Hg(NO3)2 = Hg + 2NO2↑ + O2↑
2AgNO3 = 2Ag + 2NO2 ↑+ O2↑
4) Нитрат и нитрит аммония:
Нитрат аммония разлагается в зависимости от температуры так:
NH4NO3 = N2O ↑+ 2H2O (190-245°C)
2NH4NO3 = N2↑ + 2NO + 4H2O (250-300°C)
2NH4NO3 = 2N2 ↑+ O2 + 4H2O (выше 300°C)
Нитрит аммония:
NH4NO2 = N2 ↑+ 2H2O
Дополнительно:
Исключения:
4LiNO3 = 2Li2O + 4NO2 + O2
Mn(NO3)2=MnO2 + 2NO2
4Fe(NO3)2=2Fe2O3 + 8NO2 + O2
Качественная реакция на нитрат-ион NO3– – взаимодействие нитратов c металлической медью при нагревании в присутствии концентрированной серной кислоты..
Признаки реакции - в пробирке появляются бурые пары оксида азота(IV), что лучше наблюдать на белом экране, а на границе медь – реакционная смесь появляются зеленоватые кристаллы нитрата меди(II).
Протекают следующие уравнения реакций:
КNO3 (кр.) + Н2SO4 (конц.) = КНSО4 + НNО3↑