Алюминий, его соединения.
 Алюминий находится в III A группе в 3 периоде. Поэтому он имеет 3 энергетических уровня, на которых расположены все его электроны. Порядковый номер алюминия – 13, значит у него 13 электронов в атоме. На первом энергетическом уровне 2 электрона, на втором – 8, на третьем – 3. Атом алюминия содержит 3 электрона на внешнем энергетическом уровне, которые он отдаёт и превращается в ион. Алюминий почти во всех своих соединениях имеет степень окисления +3, потому что это элемент III A группы.
Алюминий находится в III A группе в 3 периоде. Поэтому он имеет 3 энергетических уровня, на которых расположены все его электроны. Порядковый номер алюминия – 13, значит у него 13 электронов в атоме. На первом энергетическом уровне 2 электрона, на втором – 8, на третьем – 3. Атом алюминия содержит 3 электрона на внешнем энергетическом уровне, которые он отдаёт и превращается в ион. Алюминий почти во всех своих соединениях имеет степень окисления +3, потому что это элемент III A группы.

Сравним алюминий с его соседями. Радиус атома у алюминия больше, чем у его соседа сверху – бора, и восстановительные свойства у алюминия выражены значительно больше. Кроме бора у алюминия есть ещё соседи по периоду. Это кремний, радиус у кремния меньше, чем у алюминия, к тому же кремний является неметаллом и проявляет кислотные свойства. В периоде с увеличением заряда ядра атома – уменьшается радиус атома и способность элемента отдавать электроны тоже уменьшается, поэтому алюминий проявляет более слабые восстановительные и металлические свойства, чем натрий и магний, он относится к переходным металлам и занимает промежуточное положение между металлами и неметаллами, его соединения являются амфотерными.
Как простое вещество, алюминий:
· серебристо-белый металл;
· лёгкий (плотность - 2,7 г/см3);
· мягкий;
· плавится при температуре 660 0С;
· очень пластичный и легко вытягивается в проволоку и прокатывается в фольгу;
· обладает большой электро- и теплопроводностью;
· высокая упругость, то есть он не становится хрупким при низких температурах.
Нахождение в природе и его получение
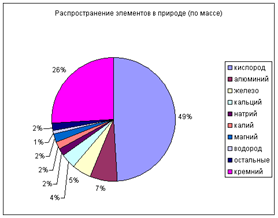
Посмотрев на диаграмму, можно с уверенностью сказать, что алюминий — самый распространенный металл в природе. Его содержание в земной коре составляет 8,8%. Он занимает третье место по распространенности среди других элементов (после кислорода и кремния).
В земной коре алюминий встречается только в виде соединений, преимущественно с кремнием и кислородом — в виде алюмосиликатов. Алюмосиликаты представляют собой соли, образованные оксидами алюминия, кремния, щелочных и щелочноземельных металлов. Алюмосиликаты входят в состав полевых шпатов.



Боксит представляет собой горную породу, из которой получают алюминий, он содержит оксид алюминия.



Корунд является минералом состава Al2O3, он очень твёрдый, егоразновидность, содержащая примеси – наждак – применяется как шлифовальный материал. Корунд содержит прозрачные и окрашенные примеси: если они красные, тогда он называется рубин, если синие – то сапфир.



Алюминий очень прочно связан в природных соединениях с кислородом и другими элементами, и выделить его из этих соединений химическими методами очень трудно.
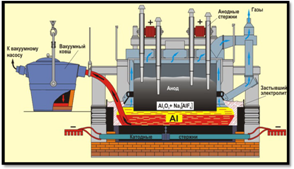
Алюминий можно получить электролизом — разложением расплава его оксида с помощью электрического тока. Но температура плавления оксида алюминия более 2000 0C. Восстановить алюминий из оксида с помощью традиционных восстановителей практически невозможно, поэтому на практике его получают методом электролиза. Проводить процесс при более высокой температуре технически очень сложно и экономически нецелесообразно. На практике вместо расплава оксида алюминия используют его раствор в криолите – Na3AlF6, который плавится при гораздо более низкой температуре.
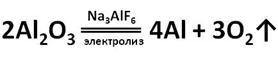
В лабораторных условиях небольшое количество алюминия можно получить путём восстановления хлорида алюминия калием при высокой температуре.
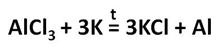
Но почему же такой распространённый в природе металл и к тому же очень важный стал известен людям менее двухсот лет назад?
Однажды к древнеримскому императору Тиберию пришёл ремесленник и принёс чашу невиданной красоты, изготовленную из серебристого и на удивление лёгкого металла. На вопрос императора о названии чудесного металла ремесленник ответил, что металл получен им из …глины и пока не имеет названия. «Дальновидный» император, испугавшись, что новый металл, который можно получать из обыкновенной глины, обесценит серебро и подорвёт могущество Рима, повелел: чашу уничтожить, ремесленника обезглавить, его мастерскую сровнять с землёй!»
…Спустя полторы тысячи лет, в шестнадцатом веке, талантливый немецкий врач и естествоиспытатель Парацельс, исследуя различные вещества и минералы, установил, что в состав некоторой минеральной породы, которую издревле применяли при крашении тканей и называли «алюмэн» (вяжущая) входит окись неизвестного металла, названная впоследствии глинозёмом. В Древней Руси эту породу называли «квасцы».
В 1754 году немецкий химик и металлург Маргграф с помощью щёлочи выделил из раствора квасцов «квасцовую землю», впоследствии названную алюминой (это и был оксид алюминия), и указал на её особые свойства.
А в 1782 году Лавуазье предположил, что алюмина или глинозём является оксидом неизвестного элемента. Уже в 1789 году алюмина была отнесена к «группе простых тел, солеобразующих и землистых ».
После нескольких неудачных попыток, выделить таинственный элемент из глинозёма с помощью гальванического тока удалось датскому ученому Эрстеду в 1825 году. Для этого он использовал соль алюминия и натрий.
Однако это осталось почти незамеченным. И только другу Эрстеда немецкому химику Вёлеру удалось разработать метод получения нового металла. На это ему потребовалось восемнадцать лет. Он использовал для этого криолит и металлический калий.
В 1855 году на Всемирной выставке в Париже было представлено «серебро из глины », которое произвело большую сенсацию. Металл был весьма дорогим, и только членам монарших семей было доступным щеголять в камзолах с алюминиевыми пуговицами и есть алюминиевыми ложками и вилками. Интересно, что даже в 1889 году алюминий оставался главным образом ювелирным металлом. Именно тогда Менделееву за его выдающиеся заслуги в развитии химии был преподнесён Лондонским королевским обществом подарок – весы, сделанные из золота и алюминия.
Так ценился алюминий. Даже у последнего русского царевича Алексея была очень дорогая игрушка – погремушка из алюминия.
И только к концу девятнадцатого века работавший в России австрийский химик Байер создал и применил в заводских условиях оригинальную технологию получения глинозёма, основного сырья для получения алюминия. Производство алюминия резко возросло, цены на него снизились в тысячи раз, и алюминий сразу приковал к себе внимание промышленного мира – электротехнической промышленности, машиностроения, автомобилестроения.
Промышленный способ производства алюминия, который в своей основе применяется до сих пор, был разработан в 1866 году двумя молодыми учёными американцем Чарльзом Холлом и французом Полем Эру, причём независимо друг от друга.
В настоящее время по объёму производства алюминий прочно занимает второе место после железа и его сплавов (среди металлов). Для выплавки одной тонны алюминия требуется от тринадцати до семнадцати тысяч квт/час электрической энергии, поэтому алюминиевые заводы расположены вблизи крупных ГЭС.
Естественно, если бы не технические трудности, алюминий давно бы был самым дешёвым металлом. Но из-за высокой химической активности, алюминий встречается в природе только в связанном виде. А из-за высокого сродства к кислороду, восстановить алюминий можно либо ещё более активным металлом, например калием, либо при помощи электролиза. Поэтому открытие этого самого распространённого металла состоялось после открытия щелочных металлов, а промышленное получение началось после изобретения электролиза.
Что касается химических свойств алюминия, то они обусловлены положением его в ряду активности металлов. Алюминий представляет собой очень активный металл, потому что в ряду напряжений металлов он стоит сразу после щелочноземельный металлов, он активнее и таких металлов, как цинк, железо, свинец, олово.

При комнатной температуре на воздухе алюминий не изменяется, потому что он покрыт прочной и тонкой плёнкой оксида, которая защищает металл от внешнего воздействия.
Но если разрушить оксидную плёнку, то алюминий показывает свой «буйный характер ». Сделать же это путём простого механического воздействия на его поверхности чем-нибудь твёрдым невозможно, поскольку очень быстро повреждённые места «залечиваются». Для этого можно использовать способность алюминия образовывать амальгаму – сплав с ртутью. Такой алюминий называется амальгамированный.
При высокой температуре алюминий энергично взаимодействует с кислородом, при этом образуется оксид алюминия. Алюминий повышает свою степень окисления с 0 до +3, а кислород понижает с 0 до -2. Четыре атома алюминия отдают по 3 электрона молекуле кислорода. Поэтому в этой реакции алюминий является восстановителем, а кислород – окислителем.
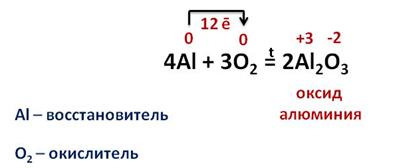
Эту реакцию можно наблюдать при горении бенгальских огней и фейерверков.

Алюминий будет взаимодействовать с неметаллами, особенно в порошкообразном состоянии. Но для того, чтобы реакция прошла, необходимо первоначальное нагревание, за исключением реакций с галогенами – хлором и бромом, но потом эти реакции идут бурно с выделением большого количества теплоты.
Например, в реакции алюминия с хлором образуется бинарное соединение – хлорид алюминия. Два атома алюминия отдают по 3электрона молекуле хлора. При этом алюминий повышает свою степень окисления с 0 до +3, а хлор понижает с 0 до -1.
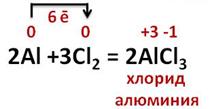
В реакции алюминия с серой образуется сульфид алюминия, два атома алюминия отдают по 3 электрона молекуле серы, при этом алюминий повышает свою степень окисления с 0 до +3, а сера понижает с 0 до -2.
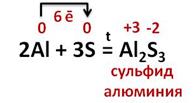
В реакции алюминия с азотом образуется бинарное соединение – нитрид алюминия, два атома алюминия отдают по 1 электрону молекуле азота, алюминий при этом повышает свою степень окисления с 0 до +3, а азот понижает с 0 до -3.
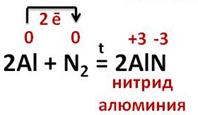
Таким образом, в этих реакциях алюминий повышает свою степень окисления, поэтому является восстановителем, а неметаллы понижают свою степень окисления, поэтому являются окислителями.
Интересно протекает реакция алюминия с йодом. Катализатором в этой реакции является вода. При этом выделяется так много теплоты, что содержащийся в смеси йод испаряется и образует густые темно-фиолетовые пары. В результате этой окислительно-восстановительной реакции образуется йодид алюминия.
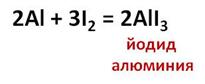
Амальгамированный алюминий реагирует с водой, при этом образуется гидроксид алюминия и водород. Алюминий в этой реакции выступает в роли восстановителя. Потому что повышает свою степень окисления, а ионы водорода выступают в роли окислителя, потому что водород понижает свою степень окисления с +1 до 0. Это уравнение химической реакции является доказательством того, что алюминий – активный металл, потому что только активные металлы могут реагировать с водой.
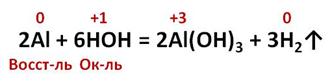
Алюминий также взаимодействует с растворами кислот с выделением водорода. Так, в реакции алюминия с серной кислотой образуется сульфат алюминия и выделяется водород, в реакции алюминия с соляной кислотой образуется соль – хлорид алюминия и выделяется водород. Алюминий в этих реакциях выступает в роли восстановителя, потому что повышает свою степень окисления с 0 до +3, а ионы водорода здесь выступают в роли окислителя, потому что водород понижает степень окисления с +1 до 0.
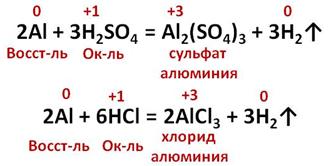
А концентрированные серная и азотная кислоты пассивируют поверхность алюминия, образуя на его поверхности прочную оксидную плёнку, которая препятствует дальнейшему протеканию реакции. Поэтому эти кислоты перевозят в алюминиевых цистернах.

Алюминий реагирует и с растворами щелочей с образованием комплексных солей. В реакции алюминия с водным раствором гидроксида калия образуется комплексная соль – тетрагидроксоалюминат калия и выделяется газ – водород. Алюминий в этой реакции выступает в роли восстановителя, а водород – в качестве окислителя.
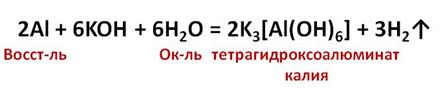
Алюминотермия — это способ восстановления многих металлов из их оксидов с помощью алюминия. Так, алюминий используется для получения хрома, марганца, ванадия, титана, циркония из их оксидов.
Будет ли протекать и реакция алюминия с оксидом железа.
Данная реакция будет протекать, так как алюминий в электрохимическом ряду напряжений стоит правее железа, то есть он будет вытеснять железо из его оксида.
Например, если эту смесь поджечь с помощью магниевой ленты, то происходит энергичная реакция с выделением большого количества теплоты.
Таким образом, алюминий является активным металлом, реагирует с простыми веществами – неметаллами, восстанавливает металлы до свободного состояния, стоящие в электрохимическом ряду напряжения справа от него. Из сложных соединений алюминий восстанавливает ионы водорода и ионы менее активных металлов. Однако при комнатной температуре на воздухе алюминий не изменяется, так как покрыт защитной оксидной пленкой.
Алюминий образует оксид состава Al2O3, который представляет собой белое, твёрдое вещество, широко распространённое в природе, с высокой температурой плавления. Оно обладает инертностью при обычных условиях. Действительно, оксид алюминия огнеупорен, является абразивным материалом, нерастворим в воде; с кислотами и щелочами, основными оксидами реагирует либо при кипячении, либо при сплавлении.
Например, при сплавлении оксида алюминия с гидроксидом калия образуется соль – метаалюминат калия – и вода, при сплавлении с оксидом кальция, который является основным оксидом, образуется соль – метаалюминат кальция. В реакции оксида алюминия с раствором гидроксида калия образуется комплексная соль – тетрагидроксоалюминат калия. В реакции оксида алюминия с раствором серной кислоты образуется соль – сульфат алюминия и вода.

Оксид алюминия может быть получен при нагревании гидроксида алюминия.
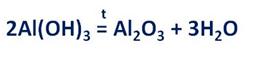
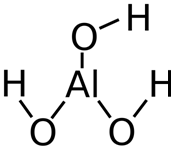
Гидроксид алюминия – Al(OH)3 – обладают амфотерными свойствами. Оксид алюминия не растворим в воде, и поэтому гидроксид алюминия получают осаждением из растворимых солей алюминия действием щелочей.
Так как гидроксид алюминия – амфотерное основание, поэтому он реагирует и с кислотами, и со щелочами. В реакции с соляной кислотой гидроксид алюминия ведёт себя как основание, а в реакции с гидроксидом натрия он ведёт себя, как кислота.
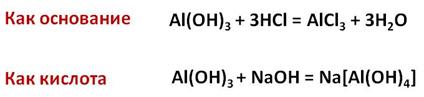
Проведём эксперимент, нальём в пробирку хлорид алюминия, а затем несколько капель щелочи. У нас образовался осадок белого цвета. Если к этому осадку добавить кислоты, то осадок растворяется. Если к этому осадку добавить щёлочь, то он также растворяется.
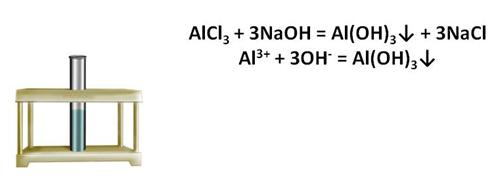
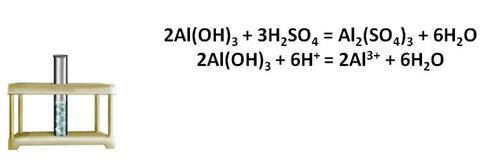
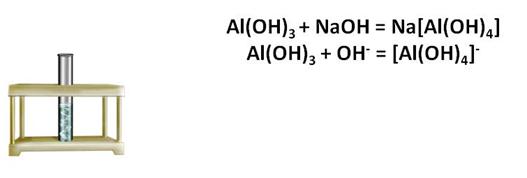
Эти реакции доказывают то, что гидроксид алюминия является амфотерным основанием.
К наиболее распространённым солям алюминия относятся соли ортоалюминиевой кислоты – H3AlO3 и метаалюминиевой – HAlO2.
К природным алюминатам относится благородная шпинель, которая украшает историческую реликвию – корону российских императоров, а также драгоценный хризоберилл.

