| Молекулярного строения | Ионного строения |
| — при обычных условиях имеют жидкое, газообразное и твёрдое агрегатное состояние; — имеют низкие значения температур кипения и плавления; — неэлектропроводные; — имеют низкую теплопроводность | — твёрдые при обычных условиях; — хрупкие; — тугоплавкие; — нелетучие; — в расплавах и растворах проводят электрический ток |
Используя данную информацию, определите, какое строение имеют вещества оксид кремния SiO2 исоль фосфата натрия Na3PO4
Запишите ответ в отведённом месте:
1) оксид кремния SiO2
2) соль фосфата натрияNa3PO4
5. Сложные вещества по составу делятся на оксиды, кислоты, основания и соли.
1. Вам даны формулы оксидов. Назовите их, укажите характер:
СаО __________________________, ______________________________
Р2О5 __________________________, ______________________________
Al2O3 __________________________, _____________________________
2. Укажите, при помощи каких реакций можно доказать амфотерность одного из них ________________________________________________________________________________________________________________________________________
|
В пищевой промышленности используется пищевая добавка Е220, которая представляет собой оксид серы (IV) SO2(сернистый газ). Она находит применение в производстве: вина и некоторых напитков, а также для консервирования продуктов, подвергаемых дальнейшей переработке. Поскольку этот газ убивает микроорганизмы, им окуривают овощехранилища и склады.
Получение оксида серы в промышленном масштабе возможно путём горения соли сульфида железа FeS2(пирита), этот процесс называется обжигом.
Сернистый газ токсичен и из-за образования в больших количествах в качестве отходов является одним из основных газов, загрязняющих атмосферу. Для очистки воздуха от сернистого газа, можно применять систему, в которой сернистый газ пропускают через раствор гашёной извести (гидроксида кальция – Ca(OH)2).
Полученная таким образом соль сульфит кальция – CaSO3 (пищевая добавка Е226) в пищевой промышленности используется как консервант, для приготовления желе, мармелада, мороженого, джема, повидла с низким содержанием сахара или добавляется в тертый чеснок, хрен, картофель для предотвращения процесса потемнения. Попадая в желудок человека, в котором содержится соляная кислота (HCl), эта соль может вступить с ней в химическую реакцию, в результате которой образуются ионы кальция.
6.
1. Составьте молекулярное уравнение реакции горения сульфида железа FeS2(пирита), которая упоминалась в тексте.
Ответ: _______________________________________________________________________________
_______________________________________________________________________________
2. Укажите, с каким тепловым эффектом (с поглощением или выделением теплоты) протекает эта реакция.
Ответ: _______________________________________________________________________________
_______________________________________________________________________________
7.
1. Составьте молекулярное уравнение реакции между гидроксидом кальция и сернистым газом, которая упоминалась в тексте.
Ответ: _______________________________________________________________________________
_______________________________________________________________________________
2. Объясните, какие признаки этой реакции позволяют использовать её для обнаружения сернистого газа в воздухе.
Ответ: _______________________________________________________________________________
_______________________________________________________________________________
8.
В лаборатории обнаружили три не подписанных пакета, содержащие порошки K3PO4, CaCO3, KNO3. Для проведения качественного анализа к пробам из каждой банки добавили водный раствор AgNO3.
1. Какие изменения можно наблюдать в результате проведения данного опыта (концентрация веществ достаточная для проведения анализа)?
Ответ: _______________________________________________________________________________
_______________________________________________________________________________
2. Запишите сокращённое ионное уравнение произошедшей химической реакции.
Ответ: _______________________________________________________________________________
_______________________________________________________________________________
9.
Дана схема окислительно-восстановительной реакции.
KI + O2 + HCl 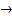 I2 + KCl + H2O
I2 + KCl + H2O
1. Составьте электронный баланс этой реакции.
Ответ: _______________________________________________________________________________
_______________________________________________________________________________
2. Укажите окислитель и восстановитель.
Ответ: _______________________________________________________________________________
_______________________________________________________________________________
3. Расставьте коэффициенты в уравнении реакции.
Ответ: _______________________________________________________________________________
_______________________________________________________________________________
10. Дана схема превращений:
H2SiO3 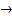 SiO2
SiO2 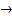 K2SiO3
K2SiO3 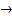 H2SiO3
H2SiO3
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения.
1) ___________________________________________________________________________________
2) ___________________________________________________________________________________
3) ___________________________________________________________________________________
11. Установите соответствие между формулой вещества и общей формулой его гомологического ряда:
А) СН3СН(СН3)СН2СНО 1) СnН2nO2
Б) СН2ОНСН2СН2СН3 2) СnН2nO
В) СН3СН2СН2СН2СООН 3) СnН2n+2O
Ответ в виде цифр запишите в таблицу:
| А | Б | В |
12. В предложенные схемы химических реакций вставьте формулы пропущенных веществ, расставьте коэффициенты:
1) С2Н5ОН + Na = …… + H2
2) CH3COH + …… = CH3COOH + 2Ag↓
13. При переработке сырой нефти прямой перегонкой выход бензина (октан) примерно 20% (по массе). Рассчитайте объем кислорода, который понадобится для сжигания всего бензина, полученного из 4,5 кг нефти.
Ответ: ____________________________________________________________________________________
____________________________________________________________________________________
____________________________________________________________________________________
14. Предельно допустимая концентрация (ПДК) – это такое содержание вредного вещества в окружающей среде, которое при постоянном контакте или при воздействии на человека за определённый промежуток времени практически не влияет на его здоровье и не вызывает неблагоприятных наследственных изменений у потомства.
ПДК метанола (CH3OH) в водных ресурсах хозяйственно-питьевого водопользования составляет 3 мг/л. В озеро промышленное предприятие сбрасывало воду с примесью метанола. Был проведён анализ и оказалось, что в озеро общим объёмом 5100 м3 попало 30,6 кг метанола. Определите, во сколько раз была превышена ПДК метанола в воде данного водоёма. Предложите способ, снижающий последствия влияния превышения ПДК на биологическую среду водоёма.
Ответ: _______________________________________________________________________________
_____________________________________________________________________________________
_____________________________________________________________________________________
15. При приготовлении варения и джема используют сахарный сироп. Для этого в горячей воде растворяют сахарозу – С12Н22О11 (сахар). В 100 г воды при 100 °С растворяется максимально 487 г сахарозы. Определите массу сахарозы и воды необходимые для получения 300 г раствора насыщенного при указанной температуре. Запишите подробное решение задачи.
Ответ: _______________________________________________________________________________
_____________________________________________________________________________________
_____________________________________________________________________________________
Вариант №2
1. Как известно, М.В. Ломоносов нагрева в запаянной реторте железные опилки до образования железной окалины. В процессе реакции масса реторты не изменилась, что дало основание для открытия закона сохранения массы веществ в химических реакциях.
А какие ещё изменения произошли в колбе кроме окисления железа?
1. Как изменилось давление в реторте? _________________________________________
2. Куда устремится воздух, если кончик реторты обломан? _________________________________________________________________________
2. На рисунке изображена модель электронного строения иона некоторого химического элемента.
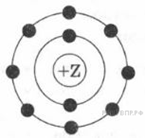
На основании анализа предложенной модели выполните следующие задания:
1) определите химический элемент, анион которого со степенью окисления −1 имеет такое электронное строение;
2) укажите номер периода и номер группы в Периодической системе химических элементов Д. И. Менделеева, в которых расположен этот элемент;
3) определите, к кислотам или основаниям относится водородное соединение, которое образует этот химический элемент.
Ответы запишите в таблицу.
| Символ химического элемента | № периода | № группы | Металл/неметалл |
3. Водородные соединения неметаллов в растворах могут проявлять как основные, так и кислотные свойства.
Расположите формулы водородных соединений неметаллов третьего периода по возрастанию кислотных свойств:
________________________________________________________________________________
4. В приведённой ниже таблице перечислены характерные свойства веществ, которые имеют молекулярное и ионное строение.