Лекция 3.
Основания. Химические свойства и получение
Химические свойства нерастворимых оснований
1. Реагируют с сильными кислотами и их оксидами с образованием соли и воды:


С оксидами слабых кислот нерастворимые основания не реагируют:

2. Разлагаются на оксид и воду при нагревании:

3. Не взаимодействуют с амфотерными оксидами и гидроксидами.
4. Некоторые нерастворимые основания могут выступать в роли восстановителей, (в случае, если металл в основании находится в низшей или промежуточной степени окисления: гидроксид железа 2, гидроксид хрома 2 и тд).
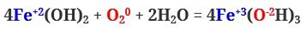
Химические свойства растворимых оснований- щелочей.
1. Щелочи взаимодействуют с любыми кислотами- и сильными, и слабыми. При этом образуются соль и вода. Реакция называется реакцией нейтрализации.

В избытке щелочи образуется средняя соль и вода, в избытке кислоты (многоосновной) – кислая соль и вода. Например, при взаимодействии гидроксида натрия с фосфорной кислотой, может образовываться три типа солей в зависимости от реагентов – фосфаты (средние соли), гидрофосфаты и дигидрофосфаты (кислые соли):

В этой реакции на одну молекулу гидроксида натрия приходится одная молекула кислота, то есть мольное соотношение 1:1. Образовалась кислая соль – дигидрофосфат.
При мольном соотношении количества кислоты и щелочи 1:2 образуется гидрофосфат:

Если возьмем на одну молекулу кислоты три молекулы щелочи – образуется средняя соль:
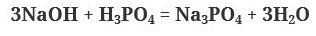
2. Щелочи взаимодействуют с амфотерными оксидами и гидроксидами. При этом в растворе образуется комплексная соль в расплаве обычная соль:



3. Щелочи взаимодействуют с кислотными оксидами с образованием соли и воды. При этом возможно образование средней или кислой соли в зависимости от мольного соотношения щелочи и оксида. В избытке щелочи образуется средняя соль, в избытке кислотного оксида – кислая соль.



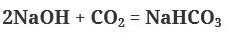
4. Щелочи реагирует с растворимыми солями в растворе, при условии образования газа или осадка. Механизм реакции –реакция ионного обмена.


Также щелочи реагируют с растворами солей аммония:

Запомните: при взаимодействии растворимых солей амфотерных металлов с щелочью, образуется комплексная соль, так как образующийся на первой стадии амфотерный гидроксид растворяется в избытке раствора щелочи:
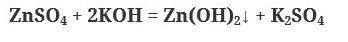

Если щелочь в недостатке, вторая реакция не протекает. Таким образом, получаем две схемы взаимодействия:
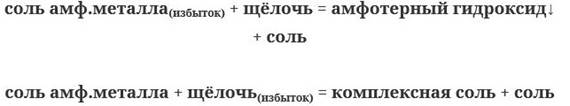
5. Щелочи реагируют с кислыми солями, при этом образуются либо менее кислая соль (если кислота трех – и более основная), либо средняя соль:


6. Щелочи реагируют в растворе и в расплаве с амфотерными металлами:

7. Щелочи взаимодействуют с неметаллами. При этом протекают реакции диспропорционирования. Инертные газы, азот, углерод, водород, кислород не реагируют с щелочами. Могут реагировать сера, хлор, бром, йод, фосфор:

если холодный раствор щелочи.
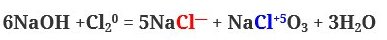
если горячий раствор щелочи
Кремний окисляется в растворах щелочей до +4:

Фтор сам окисляет щелочи:

8. Щелочи не разлагаются при нагревании, исключением является гидрокисд лития:

Получение оснований
1. Взаимодейстиве основных оксидов с водой. При этом с водой реагируют только те основания, у которых есть соответствующие щелочи:


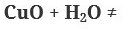
2. Взаимодействие щелочных и щелочноземельных металлов с водой:
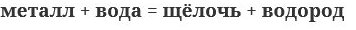

3. Электролиз растворов солей щелочных металлов и безкислородных кислот (кроме плавиковой):
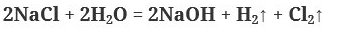
4. Взаимодейстиве растворов солей с растворами щелочей:

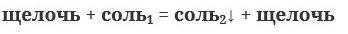


Задания









10. Установите соответствие между реагирующими веществами и продуктами:

11. Установите соответствие между реагирующими веществами и продуктами:

12. Установите соответствие между реагирующими веществами и продуктами:
