|
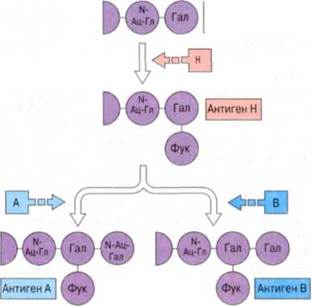
Схема, иллюстрирующая формирование системы групп крови АВО. Фермент, кодируемый геном Н, прикрепляет остаток фукозы (Фук) к терминальному гала-ктозному (Гал) остатку олигосахаридного предшественника. У лиц, обладающих геном А, к этому остатку галактозы присоединяется N-ацетилгалактозамин (N-Ац-Гал), а у лиц с геном В - вторая молекула галактозы; в результате образуются антигены АиВ соотсоответственно. У лиц с обоими генами образуются оба антигена. В таблице указаны генотипы и антигены системы АВО. У большинства людей продуцируются «естественные» антитела к отсутствующим у них антигенам.
Антигены минорных систем групп крови вызывают менее выраженные реакции, которые можно зарегистрировать только с помощью непрямого теста Кумбса. При переливании цельной крови необходимо убедиться и в том, что сыворотка донора не содержит антител к эритроцитам реципиента. Однако переливание цельной крови осуществляют редко [3]. Донорскую кровь обычно разделяют на клеточную и сывороточную фракции, которые используют порознь.
При трансфузионных реакциях происходит массовое разрушение клеток крови хозяина [3].
Трансфузия эритроцитов реципиенту, у которого имеются антитела к этим клеткам, вызывает немедленную реакцию — лихорадку, падение давления, тошноту и рвоту, а также боли в спине и груди. Тяжесть реакции зависит от класса и количества участвующих в ней антител [3].
Антитела к антигенам системы АВО обычно относятся к классу IgM и вызывают агглютинацию, активацию комплемента и внутрисосудистый гемолиз [3].
Другие системы групповых антигенов крови индуцируют образование антител IgG, которые по сравнению с IgM слабее агглютинируют эритроциты. Клетки, сенсибилизированные IgG, обычно поглощаются фагоцитами печени и селезенки, хотя при тяжелых реакциях разрушение эритроцитов происходит и вследствие активации комплемента. В таких случаях возможно развитие коллапса, а выделяющееся содержимое эритроцитов может вызвать острый некроз почечных канальцев. Эти острые трансфузионные реакции часто наблюдаются у несенсибилизированных лиц и развиваются через несколько суток или недель, по мере образования антител к чужеродным клеткам. В результате возникает анемия или желтуха.
Возможны трансфузионные реакции и на другие компоненты крови, хотя их последствия, как правило, не столь серьезны, как реакций на эритроциты [3].
Сверхострое отторжение трансплантата связано с трансфузионной реакцией.
В тех случаях, когда у реципиента уже имеются антитела к трансплантируемой ткани, происходит сверхострое отторжение трансплантата. Оно возможно лишь в отношении тех тканей, которые реваскуляризуются сразу же после пересадки, например при пересадке почки. Наиболее тяжелые реакции отторжения этого типа обусловлены антигенами системы АВО, присутствующими на почечных клетках. Повреждение вызывают антитела и активация комплемента в кровеносных сосудах с последующим привлечением и активацией нейтрофилов и тромбоцитов. Однако в настоящее время, благодаря тщательному подбору доноров и реципиентов по антигенам АВО, такие реакции наблюдаются крайне редко. Антитела к другим антигенам трансплантата (например, молекулам МЫС), образовавшиеся при предыдущих пересадках, также могут вызывать реакции этого типа [3].
Переливание несовместимой крови часто является следствием неправильного типирования крови донора или реципиента, еще чаще — следствием ошибочных или просто небрежных записей и действий медицинского персонала (неправильная или неразборчивая маркировка, проведение пробы на индивидуальную совместимость не с тем образцом крови, использование контейнера, предназначавшегося другому реципиенту, и т. п.) [2].
При переливании несовместимой крови под действием анти-A- или анти-B-изоагглютининов (либо других антител реципиента) происходит агглютинация донорских эритроцитов. Активируется комплемент, разрушаются мембраны эритроцитов и развивается внутрисосудистый гемолиз. Отмечаются следующие симптомы: лихорадка, озноб, боль в груди, артериальная гипотония, тошнота, гиперемия, одышка; возможны гемоглобинурия, кровоточивость, олигурия или анурия. Боль в пояснице, традиционно считающаяся характерным признаком внутрисосудистого гемолиза, на самом деле встречается довольно редко. Наиболее опасное последствие гемолитической реакции — ДВС-синдром, приводящий к почечной недостаточности. Во время общей анестезии гемолитические реакции особенно опасны, поскольку симптомокомплекс замаскирован анестетиками. Первым проявлением гемолитической реакции может быть необычная кровоточивость.
Признаки гемолитической реакции, как правило, появляются при введении первого децилитра несовместимой крови; поэтому в начале переливания следует внимательно наблюдать за больным [1].
При подозрении на гемолитическую реакцию переливание немедленно прекращают. Остаток донорской крови, образцы крови и мочи реципиента отправляют в лабораторию. Для выявления серологической несовместимости повторно определяют группы крови и Rh-фактор донора и реципиента, повторно ставят пробу на индивидуальную совместимость, проводят непрямую пробу Кумбса. Сыворотку реципиента исследуют на присутствие антител к редким антигенам; для этого используют панель эритроцитов с известными антигенными свойствами. Высокое содержание в плазме свободного гемоглобина, низкий уровень сывороточного гаптоглобина и гемоглобинурия подтверждают диагноз гемолитической реакции [2].
Лечение. Прекращают переливание несовместимой крови и начинают инфузионную терапию, при необходимости — под контролем ДЗЛА. Особенно важно быстро начать лечение при шоке. Вводят 0,9% NaCl с такой скоростью, чтобы диурез составлял как минимум 100 мл/ч. Солевой диурез — важнейший компонент лечения [2]. Сосудосуживающие средства (за исключением малых доз дофамина) противопоказаны. Целесообразность назначения маннитола, широко применявшегося раньше, весьма сомнительна. После восстановления ОЦК можно осторожно применять петлевые диуретики. Ощелачивание мочи бикарбонатом натрия предотвращает осаждение свободного гемоглобина в почечных канальцах [1]. Общепринятой схемы лечения ДВС-синдрома, развившегося в ходе гемолитической реакции, не существует. Применение гепарина, рекомендуемое в специальной литературе, небезопасно, особенно в тех случаях, когда показанием к переливанию крови было кровотечение [1]. Если гепарин все же назначают, насыщающую дозу 2000—4000 ед вводят в/в струйно быстро, затем в течении 6—24 ч проводят инфузию со скоростью 1500 ед/ч. В тяжелых случаях прибегают к переливанию тромбоцитарной массы и свежезамороженной плазмы. Необходима срочная консультация гематолога и нефролога [1].
3) Трансфузионная реакция «Трансплантант против хозяина».
Обычно наблюдается у реципиентов с иммунодефицитом. Принято считать, что она обусловлена инфузией иммунокомпетентных Т-лимфоцитов (N.Engl. J. Med. 323:315, 1990). Реакция «трансплантант против хозяина» описана у реципиентов без нарушения иммунной системы, но с таким же галотипом HLA, как у HLA- гомозиготных доноров (обычно, родственников реципиента) [12]. Группы тканевых антигенов, получивших название HLA, контролируется участком хромосомы 6, содержащимнесколько генетических локусов, в каждом из которых имеются множественные аллели. Эти антигены имеют отношение к реакции отторжения трансплантантов. В разных концентрациях HLA найдены практически на всех клетках с ядрами. Иммунологическая реакция на эти антигены – главная причина большинства случаев трансфузионной реакции «трансплантант против хозяина».
Главный механизм, лежащий в основе острого отторжения,- это иммунная реакция «хозяин против трансплантанта», направленная против трансплантационных антигенов и опосредуемая лимфоцитами. Она относится к реакциям гиперчувствительности замедленного типа [3]. Гистологически для нее характерны инфильтрация мононуклеарами, кровоизлияния и отеки, выраженность которых варьирует.
Аллергические реакции IV типа (опосредованные Т-клетками)
Эта форма реактивности сформировалась на поздних этапах эволюции на основе иммунологических реакций и воспаления. Она направлена на распознавание и ограничение действия аллергена. Гиперчувствительность IV типа лежит в основе многих аллергических и инфекционных заболеваний, аутоиммунных болезней, отторжения трансплантата (трансплантационный иммунитет), контактного дерматита (контактная аллергия), противоопухолевого иммунитета [11].
Этиология и особенности антигенной стимуляции при ГЗТ. Антигены, индуцирующие ГЗТ, могут иметь различное происхождение: микробы (например, возбудители туберкулеза, бруцеллеза, сальмонеллеза, дифтерии, стрептококки, стафилококки), вирусы коровьей оспы, герпеса, кори, грибы, тканевые белки (например, коллаген), антигенные полимеры аминокислот, низкомолекулярные органические соединения [11]. По химической природе антигены, которые способны вызвать ГЗТ, относятся чаще к белковым соединениям. Белки, вызывающие ГЗТ, отличаются низкой молекулярной массой и “слабыми” иммуногенными свойствами. Поэтому они не способны в достаточной мере стимулировать антителообразование. При этом иммунологическая реакция при ГЗТ обладает рядом отличительных особенностей. Иммунный ответ направлен не только по отношению к гаптену, как это имеет место при реакциях немедленного типа, но и к белку-носителю, причем специфичность в отношении антигена при ГЗТ выражена гораздо сильнее, чем при реакциях немедленного типа. Разрешающий антиген при ГЗТ должен быть обязательно представлен комплексом антигена и белка-носителя, а при реакциях немедленного типа в этой роли может выступать один гаптен [11].
На формирование ГЗТ может оказать влияние не только качество, но и количество поступающего в организм антигена. Как правило, для воспроизведения ГЗТ требуется небольшое количество антигена (микрограммы) [3].
Патогенез аллергической реакции IV типа. Условно в развитии ГЗТ, как и в аллергических реакциях I, II, III типов, можно выделить три периода [2]:
I. Иммунологическая стадия. Поступающий в организм антиген чаще всего встречается с макрофагом, обрабатывается им, а затем в переработанном виде передается Т-лимфоцитам-индукторам, имеющим на своей поверхности рецепторы для антигена. Клетки-индукторы распознают антиген, а затем с помощью интерлейкинов (веществ-посредников, выделяемых макрофагами и лимфоцитами) запускают пролиферацию антигенраспознающих клеток - Т-эффекторов (Т-киллеров), а также клеток памяти. Последнее немаловажно. Клетки памяти позволяют сформировать быстрый иммунный ответ при повторном попадании антигена в организм. Осуществляющие ГЗТ иммунные лимфоциты захватывают антиген, по-видимому, в непосредственной близости от места его введения. Необходимым условием активации лимфоцитов является одновременное связывание Т-клетки как с антигеном, так и с молекулами главного комплекса гистосовместимости (ГКГ). В результате одновременного “двойного распознавания” антигена и продуктов ГКГ начинается пролиферация клеток (трансформация лимфоцитов) и превращение их из зрелых в бласты.
II. Патохимическая стадия [2]. Антигенная стимуляция лимфоцитов сопровождается их трансформацией, образованием и дальнейшим выделением медиаторов ГЗТ-лимфокинов. Для каждого медиатора на клетках-мишенях обнаружены рецепторы. Действие медиаторов неспецифично (для их действия не нужен антиген). Биологический эффект лимфокинов разнообразен. Они изменяют клеточную подвижность, активируют клетки, участвующие в воспалении, способствуют пролиферации и созреванию клеток, регулируют кооперацию иммунокомпетентных клеток. Клетками-мишенями для них служат: макрофаги и нейтрофилы, лимфоциты, фибробласты, стволовые клетки костного мозга, опухолевые клетки, остеокласты и др. Все лимфокины - белки, большинство из них - гликопротеиды.
В зависимости от оказываемого эффекта лимфокины делят на две большие группы [2]:
1) факторы, подавляющие функциональную активность клеток (фактор, угнетающий миграцию макрофагов или лимфоцитов; фактор, агглютинирующий макрофаги; хемотаксические факторы; лимфотоксины);
2) факторы, усиливающие функциональную активность клеток (фактор переноса; факторы, активирующие макрофаги или лимфоциты; митогенный фактор и др.).
III. Патофизиологическая стадия [2]. Зависит от природы этиологического фактора и той ткани, где “разыгрывается” патологический процесс. Это могут быть процессы, протекающие в коже, суставах, внутренних органах. В воспалительном инфильтрате преобладают мононуклеарные клетки (лимфоциты, моноциты и макрофаги). Нарушение микроциркуляции в очаге повреждения объясняется повышением проницаемости сосудов под влиянием медиаторов белковой природы (кинины, гидролитические ферменты, фактор проницаемости), а также активацией свертывающей системы крови и усилением образования фибрина [2]. Отсутствие значительного отека, так характерного для аллергических поражений при реакциях немедленного типа, связано с весьма ограниченной ролью гистамина в ГЗТ [11].
При ГЗТ повреждение может развиваться в результате:
1) прямого цитотоксического действия сенсибилизированных Т-лимфоцитов на клетки-мишени, которые приобрели аутоаллергенные свойства (растворимый лимфотоксин и комплемент не принимают участие в этом процессе) [12];
2) цитотоксического действия лимфотоксинов (так как действие лимфотоксина неспецифично, то повреждаться могут не только те клетки, которые вызвали его образование, но и интактные клетки в зоне его образования) [12];
3) выделения в процессе фагоцитоза лизосомальных ферментов, повреждающих тканевые структуры (эти ферменты выделяют в первую очередь макрофаги) [12].
Составной частью ГЗТ является воспаление, которое подключается к иммунной реакции действием медиаторов патохимической стадии. Как и при иммунокомплексном типе аллергических реакций, оно подключается в качестве защитного механизма, способствующего фиксации, разрушению и элиминации аллергена [3]. Однако воспаление является одновременно фактором повреждения и нарушения функции тех органов, где оно развивается, и ему принадлежит важнейшая патогенетическая роль в развитии инфекционно-аллергических, аутоиммунных и некоторых других заболеваниях. Результаты, сходные с отторжением при участии антител, обычно получают, если при гемотрансфузии не учитывают совместимость по группам крови между донором и реципиентом, а также отсутствие в сыворотке реципиента антител к антигенам донора. В таких случаях эффективным превентивным средством служит облучение всех препаратов крови, предназначенных для переливания. Доза от 15 до 30 Гр не повреждает никакие другие компоненты крови, кроме лимфоцитов, и представляется клинически адекватной. В случае целевого донорства лиц первой степени родства их кровь рекомендуется перед переливанием также облучать, даже если HLA-тип не известен [12].
4. Выводы.
1) Переливание крови следует расценивать как операцию трансплантации со всеми вытекающими из этого последствиями – возможным отторжением клеточных и плазменных компонентов крови, развитием аллосенсибилизации к антигенам клеток крови и белков плазмы, а также, при иммунодефицитном состоянии больного, возможным развитием жизненно опасной реакции «трансплантант против хозяина» [6].
2) Разработка общедоступных методов получения отдельных компонентов крови, широкое и эффективное применение их в лечебной практике при различных патологических состояниях позволяет считать, что показаний для переливания цельной крови нет. Оправдано переливание крови только при отсутствии необходимых компонентов (эритроцитной массы, свежезамороженной плазмы и т.д.) в случаях острых массивных кровопотерь [1].
3) При проведении трансфузионной терапии необходимо придерживаться принципа «один донор – один реципиент», суть которого сводится к использованию в лечении одного больного переливаний компонентов крови от одного или минимального числа доноров [6].
4) Неблагоприятные последствия трансфузионной терапии, которые проявляются в виде посттрансфузионных реакций и осложнений, возникают при отступлении от четких правил, а также при нарушении порядка серологических исследований перед проведением гемотрансфузии [7].
5) Гемотрансфузии при тщательном учете показаний и противопоказаний, соблюдении установленных правил по технике и методике проведения и выполнении всех серологических реакций являются сравнительно безопасным методом лечения [6].
Список использованной литературы:
1. А.Г. Румянцев, В.А. Аграненко. Клиническая трансфузиология. «ГЭОТАР МЕДИЦИНА» Москва, 1997 г.
2. Руководство по трансфузионной медицине. Под ред. Е.П. Сведенцева. Киров, 1999г.
3. А. Райт, Дж. Бретофф, Д. Мейл. Иммунология. Издательство «МИР», Москва, 2000 г.
4. Д.А. Еникеев. Патофизиология экстремальных и терминальных состояний. Учебное руководство. Уфа, 1997 г.
5. Д.А. Еникеев, С.А. Еникеева. Местные аллергические реакции и реанимация. Уфа, 1999 г.
6. Инструкция по переливанию крови и её компонентов. Министерство здравоохранения РФ. 1995г.
7. Аграненко В.А., Скачилова Н.Н. Гемотрансфузионные реакции и осложнения. Москва, 1991 г.
8. Дуткевич И.Г. Возможности трансфузионной терапии и показания к её применению. Трансфузионная медицина. Спец. выпуск журнала «Медицинские технологии». СПб. 1995 г. №5, стр. 44-48.
9. Шевченко Ю.Л., Жибурт Е.Б. Безопасное переливание крови. Руководство для врачей. СПб:Питер, 2000 г. стр. 320.
10. Минеева Н.В., Кирина О.Н. Гемолитические трансфузионные реакции: причины возникновения, механизмы развития, вопросы профилактики. Трансфузионная медицина. Спец. выпуск журнала «Медицинские технологии». СПб., 1995 г., №5, стр. 73-75.
11. В.И. Пыцкий, н.в. Адрианова, А.В. Артомасова. Аллергические заболевания. Москва, Медицина, 1991.
12. Мерк, Шарп и Доум. Руководство по медицине в двух томах. Издательство «Мир», 1997 г.