Изомерия по отсутствию либо наличию и характеру ветвления углеродной цепи свойственна всем карбонильным соединениям: альдегидам с 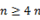 и кетонам с
и кетонам с 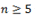 . Ацетальдегид и формальдегид изомеров не имеют.
. Ацетальдегид и формальдегид изомеров не имеют.
Например, альдегиды состава 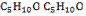 образуют изомеры:
образуют изомеры:
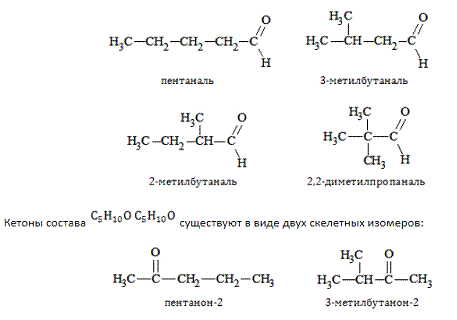
Межклассовая изомерия.
Из единой для двух классов соединений общей формулы следует, что альдегиды и кетоны одинакового атомного состава – взаимные изомеры:
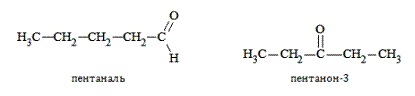
Кроме того, они обладают межклассовой изомерией с такими соединениями, как:
· непредельные спирты – алкенолы (при 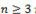 );
);
· простые эфиры (при 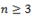 );
);
· циклические оксиды (при 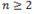 ).
).
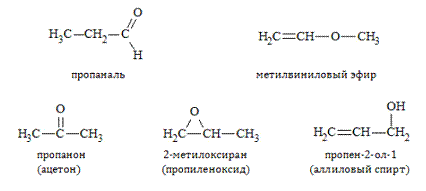
Гомологические ряды альдегидов и кетонов.
Ряды, образуемые насыщенными карбонильными соединениями, представлены в таблице:
Физические свойства карбонильных соединений.
Карбонильные соединения не образуют между собой водородных связей, поскольку в их молекулах нет атомов водорода с частичным положительным зарядом δ+ на нём. Формальдегид – газ, остальные – жидкости или твёрдые вещества. Формальдегид, ацетальдегид и ацетон хорошо растворимы в воде, что можно объяснить установлением водородных связей между молекулами этих соединений и воды:
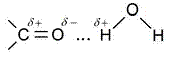
Увеличение числа углеродных атомов в углеводородном радикале приводит к снижению растворимости алифатических альдегидов и кетонов.
Химические свойства альдегидов и кетонов.
Альдегиды — один из наиболее реакционноспособных классов органических соединений, что связано с наличием в их молекулах высокополяризованной карбонильной группы >С=О.
Для альдегидов характерны реакции присоединения, окисления, полимеризации и поликонденсации.
I. Реакции присоединения.
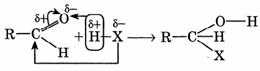
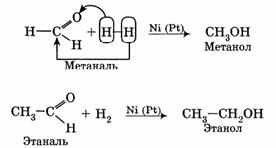
1. Гидрирование (восстановление) с образованием первичных спиртов RCH2OH.
2. Присоединение спиртов с образованием полуацеталей.
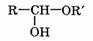
При взаимодействии альдегидов со спиртами образуются полуацетали:
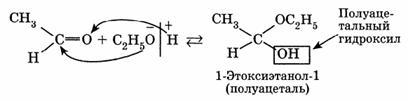
Гидроксильная группа полуацеталей (полуацетальный гидроксил) очень реакционноспособна. В присутствии катализатора — хлороводорода НС1 и при избытке спирта образуются ацетали RCH(OR')2:
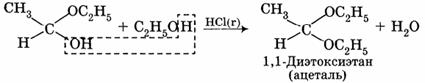
3. Присоединение гидросульфита натрия NaHSO3 с образованием гидросульфитных производных альдегидов:
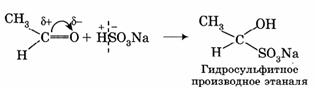
Этой реакцией часто пользуются для выделения альдегидов из смесей или с целью их очистки.
4. Присоединение синильной кислоты. Альдегиды и кетоны реагируют с синильной кислотой HCN, образуя гидроксинитрилы – соединения, содержащие у одного атома углерода ОН- и CN-группу: >C(OH)CºN. Реакция примечательна тем, что позволяет увеличивать углеродную цепь (возникает новая связь С-С).
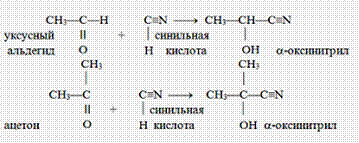
II. Реакции окисления.
В молекулах альдегидов атом углерода карбонильной группы, имеющий избыточный положительный заряд, притягивает к себе электроны связи С—Н. Вследствие этого атом водорода приобретает большую реакционную активность, что проявляется в способности альдегидов к окислению. Альдегиды легко окисляются до карбоновых кислот с тем же числом углеродных атомов различными окислителями (сильные окислители: О2 воздуха, подкисленный раствор К2Сr2О7 или КМnО4; слабые окислители: аммиачный раствор оксида серебра (I), щелочной раствор сульфата меди (II) и др.):
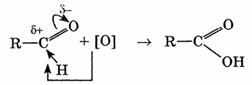
1. Взаимодействие с аммиачным раствором оксида серебра (I) — «реакция серебряного зеркала».
Оксид серебра (I) образуется в результате взаимодействия нитрата серебра (I) с NH4OH:
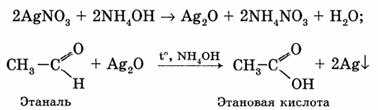
Металлическое серебро осаждается на стенках пробирки в виде тонкого слоя, образуя зеркальную поверхность.
2. Взаимодействие с гидроксидом меди (II)
Для реакции используют свежеприготовленный Сu(ОН)2, образующийся при взаимодействии растворимой соли меди (II) со щелочью:
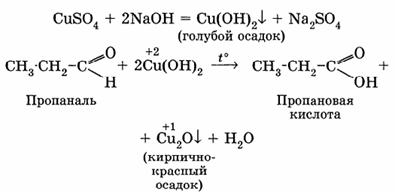
III. Реакции полимеризации. (характерны для низших альдегидов)
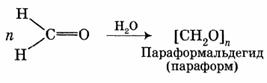
1. Линейная полимеризация
При испарении или длительном стоянии раствора формальдегида происходит образование полимера с п = 8—100 — параформальдегида:
Полимеризация безводного формальдегида в присутствии катализатора — пентакарбонила железа Fe(CO)5 — приводит к образованию высокомолекулярного соединения с п ~ 1000 — полиформальдегида (полиоксиметилен, полиметиленоксид):
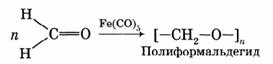
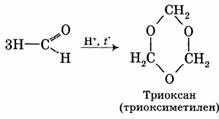
2. Циклическая полимеризация (тримеризация).
Тример метаналя получается при перегонке подкисленного раствора формальдегида: