ОП.02
Практическое занятие №3
Раздел III: Количественный анализ
Тема 3.1 Основные принципы
урока количественного анализа.
дисциплины
Цель: Изучить способы решения задач и виды записи результатов количественного анализа.
Тема практической работы № 3:
· Решение задач по теме «Основные принципы количественного анализа.
Цель:
· Ознакомить обучающихся с методикой решения в количественном анализе.
.
Оснащение: ручка, карандаш, рабочая тетрадь (лист А4).
Форма организации: индивидуально-групповая.
Теоретические основы:
Одним из методов определения концентрации растворов является объемный анализ. Он сводится к измерению объемов растворов реагирующих веществ, концентрация одного из которых неизвестна. Этот процесс называется титрованием.
Концентрация растворов может быть выражена различным образом. При определении объемов растворов реагирующих веществ наиболее целесообразным является выражение концентрации числом грамм-эквивалентов растворенного вещества, содержащихся в одном литре раствора.
Пример:
Если в литре раствора серной кислоты содержится 24,5 г H2SO4, что составляет 0,5 г-экв (эквивалент равен молекулярной массе, деленной на «2»), то такой раствор называется полунормальным (0,5н).
Раствор серной кислоты (H2SO4), содержащий в 1 литре 2,0588 г H2SO4, является 0,0512н, т.к. 2,5088 г H2SO4 равны её 0,0512 г-экв.
Согласно закону эквивалентности, все вещества реагируют между собой в количествах пропорциональных их эквивалентам. Поэтому растворы различных веществ одинаковой нормальности реагируют между собой в равных объемах, а растворы разной нормальности реагируют в объемах, обратно пропорциональных их нормальностям.
V1 H2 V1; V2 – объемы
= или V1H1=V2H2 Н1; Н2 - нормальность
V2 H1
Количественное определение содержания в растворах кислот и щелочей чаще всего производится методом, основанным на реакции нейтрализации (метод нейтрализации).
Пример 1:
Для нейтрализации 30 мл раствора щелочи потребовалось 12 мл 0,1н раствора кислоты. Определить нормальность раствора щелочи.
Решение:
- Используем при решении данной задачи уравнение
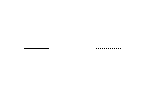
V1 H2
=; V1H1=V2H2
V2 H1
- Подставим в формулу известные нам величины:
V1 –H1=V2 –H2 30 – Нщ = 12 –0,1; где Нщ – нормальность щелочи
12–0,1
Нщ = --------- = 0,04н
Пример 2:
Определить весовое количество гидроксида натрия, содержащееся в 100 мл раствора, если на нейтрализацию 10 мл этого раствора потребовалось 25 мл 0,5н раствора кислоты.
Решение:
- Воспользуемся формулой:
V1–H1 = V2–H2
- Подставим в формулу известные величины:
25 – 0,5 = 10 – Н NaOH,
откуда получим
25–0,5
НNaOH = ---------- = 1,25н
- Нормальность равная 1,25 означает, что в 1000 мл раствора содержится 1,25 г-экв NaOH, а в 100 мл раствора содержится 0,125 г-экв NaOH,
- Т.к. г-экв NaOH равен 40 г, во весовое количество NaOH, содержащееся в 100 мл раствора:
m = 0,125 – 40 = 0,5 г
Ход работы
I. Вводный инструктаж:
· актуализация опорных знаний
· объяснение практической работы
· инструктаж по технике безопасности
Задание 1: Выполнить расчеты в количественном анализе.
Сколько граммов карбоната натрия (Na2CO3) было взято, если после растворения его в мерной колбе на 250 мл и доведения до метки взяли 25,00 мл пипеткой и на титрование пошло 20,20 мл 0,1010 н раствора соляной кислоты?
Общий алгоритм решения расчетных задач
- Прочитать текст химической расчетной задачи.
- Записать краткое условие и требование задачи с помощью общепринятых условных обозначений.
- Составить химические формулы уравнения реакций в соответствии с содержанием химической расчетной задачи и её требованиям.
- Составить план решения задачи.
- Подумать о дополнительных данных, которые можно извлечь их химических формул, уравнений реакций для реализации требований задачи.
- Произведите все необходимые расчеты с математической точностью.
- Запишите полученный ответ.
Контрольные вопросы
- Являются ли пипетки и бюретки измерительными приборами?
- В чем различие (по назначению) пипетки от бюретки?
- Какие ошибки возможны при работе с пипеткой, бюреткой?
- Положение жидкости в бюретке и глаз наблюдателя за работой с бюреткой?
- Почему при титровании берут три пробы?
- Какие расхождения допускаются в параллельных пробах при титровании?
Литература:
Александрова Э.А., Аналитическая химия. Теоретические основы и лабораторный практикум. В 2-х т. Т. 2 Физико-химические методы анализа / Э.А. Александрова – М.: Колос С. 2011
Алов Н.В., Аналитическая химия и физико-химические методы анализа. В 2-х т. Учебник / Н.А.Алов – М.:ИЦ Академия. 2012
Критерии оценки практического, лабораторного задания
«5» - проявление познавательной активности,
качественное выполнение работы,
верные выводы
«4» - проявление познавательной активности,
частичное выполнение работы,
неточность в ответе
«3» - пассивность,
созерцательный познавательный интерес к изучаемой теме,
отсутствие стремления выполнить более сложные задания
«2» - отсутствие выполненного материала,
некачественное выполнение работы,
непонимание темы,
неверные ответы на контрольные вопросы.